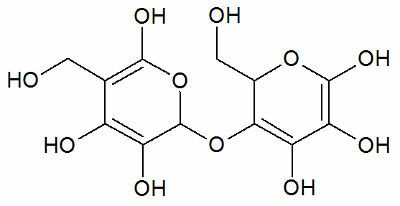
Nitrater är oorganiska föreningar som innehåller anjonen NO3-.
Kväve kommer från familj 15, har 5 elektroner i valensskalet och måste göra tre kovalenta bindningar (med delningselektroner) för att ha åtta elektroner i valensskalet och därmed stanna stabil. Emellertid har varje syre 6 elektroner i det sista skalet och därför måste var och en av dess atomer skapa två bindningar för att vara stabila.
Så i nitratanjonen är kväve det centrala elementet, vilket gör en dubbelbindning med en av oxygenerna, som är stabil, en enkelbindning med en av de andra två oxygenerna, och med den andra en kovalent bindning dativ. Detta betyder att en av oxygenerna inte är stabil utan behöver ta emot ytterligare 1 elektron, vilket ger en total laddning lika med -1. Med dativet gör kväve en bindning mer än vad den kunde göra, donera en av dess elektroner och få en laddning lika med +1. Se nedan strukturen för denna anjon:

Denna anjon kan ta emot en elektron och bilda en elektriskt neutral förening, ett oorganiskt salt. Dessa föreningar är alla vattenlösliga.
De viktigaste tillämpningarna av nitrater är i läkemedel, såsom vasodilatatorer vid behandling av angina pectoris (smärta i orsakad av låg syretillförsel genom blodflöde till hjärtmuskeln) och erektil dysfunktion manlig. De används också i gödningsmedel och sprängämnen, vilket kommer att nämnas senare.
Nitrater kan produceras genom en salpetersyra (HNO) neutraliseringsreaktion.3) med viss grund. Se exemplet nedan, där magnesiumnitrat bildades:
HNO3 + Mg (OH)2 → Mg (NO3)2+ H2O
Tre huvudsakliga exempel på denna typ av förening är natriumnitrat (NaNO3), kaliumnitrat (KNO3) och ammoniumnitrat (NH4VID3). I alla dessa fall är katjonerna (Na+, K+ och NH4+) tillhandahålla 1 elektron för en nitratanjon. Men i verkligheten lockar dessa motsatta laddningar varandra och bildar väldefinierade joniska kluster, som är kristallgitteren. Således är nitrater vanligtvis kristallina fasta ämnen, såsom visas nedan när det gäller natriumnitrat:
Sluta inte nu... Det finns mer efter reklam;)

Denna förening används vid tillverkning av gödselmedel, men den är främst känd som Chilensk saltpeter, eftersom det finns stora avlagringar av det i de chilenska öknarna. Det omvandlas till kaliumnitrat, som används för att göra det svarta pulvret som används i olika vapen och sprängämnen.

Både natriumnitrat och kaliumnitrat kallas "saltpeter", och används ofta som konserveringsmedel av färgen på konserverat och rökt kött, liksom i vissa livsmedel för att ge en större känsla av mättnad. Men deras konsumtion orsakar allvarliga hälsoskador, eftersom dessa nitrater kan transformeras av bakterier från organism till nitriter och senare till nitrosaminer, som är cancerframkallande, vilket främst orsakar cancer i mage. Nitriter omvandlar också hemoglobinerna i blodet, vilket gör att de inte kan bära syre.
De främsta orsakerna till överskott av nitrat är användningen av kvävegödselmedel vid odling av grönsaker.
Saltpeter är också farligt eftersom det ökar koncentrationen av natriumjoner i kroppen, vilket kan orsaka hjärtproblem som högt blodtryck.
O ammoniumnitrat den används också som gödningsmedel och sprängämne och användes till och med med eldningsolja i terrorattacken på World Trade Center-byggnaderna den 11 september 2001.

I attacken mot World Trade Center användes ammoniumnitrat *
* Bild copyright: Dan Howell och Shutterstock.com
Av Jennifer Fogaça
Examen i kemi
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Nitrater"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/nitratos.htm. Åtkomst den 27 juni 2021.
Kemi

Vardagssalter, kalciumkarbonat, natriumklorid, natriumfluorid, kaliumnitrat, natriumnitrat natrium, natriumkarbonat, natriumbikarbonat, natriumbikarbonat, natriumsulfit, saltpeter, soda.