Atomnumret, symboliserat med bokstaven Z, motsvarar mängden protoner som finns i atomkärnan hos ett givet kemiskt element. Till exempel är atomantalet väte 1, vilket betyder att det bara har 1 proton i sin atomkärna.
Atomenumret visas vanligtvis bredvid det kemiska elementets prenumerationssymbol (i det nedre hörnet) till vänster. Exempel: 1H.
I marktillståndet är atomnumret lika med antalet elektroner, eftersom i detta tillstånd är elementet neutralt måste därför mängden positiva laddningar (protoner) vara lika med mängden negativa laddningar (elektroner) av atom.
Atomtalet är viktigt för det är han som bestämmer elementets huvudsakliga egenskaper och egenskaper, liksom dess beteende och placering i det periodiska systemet. Elementen är listade i det periodiska systemet i stigande ordning med atomnummer, som vanligtvis visas ovanför elementet, som visas nedan. Observera att det första elementet är väte, H (Z = 1), följt av helium, He (Z = 2), sedan kommer litium, Li (Z = 3), och så vidare.
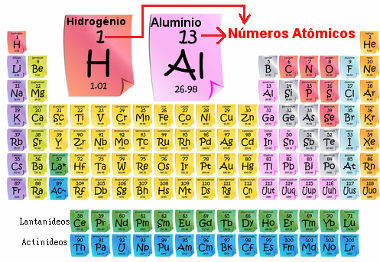
Atomiskt antal element i det periodiska systemet
Vi kan till och med föreställa oss ett kemiskt element som varande ”En uppsättning atomer som har samma atomnummer”. När vi till exempel talar om det kemiska grundämnet syre, så talar vi om atomer med atomnummer 8. Nedan har vi atomernas kemiska element från perioderna 1 och 2 i det periodiska systemet i stigande ordning med atomnummer:

Kemiska element från perioderna 1 och 2 i det periodiska systemet i stigande ordning med atomnummer
Atomtalen definierades ursprungligen av den engelska fysikern Henry Gwyn Jeffreys Moseley (1887-1915) och när man utför experiment som involverar bombningen av olika element kemister med röntgenstrålar, observerade han att kvadratroten av röntgenstrålningens frekvens som producerades genom utsläpp av atomkärnan var direkt proportionell mot atomnummer för elementet i tabellen. Periodisk. Med detta drog han slutsatsen att atomnumret var relaterat till atomernas egenskaper eftersom det representerade antalet positiva laddningar i kärnan i varje atom.
Kemiska bindningar påverkar inte atomernas atomantal, eftersom de endast involverar elektroner som finns i elektrosfären. Emellertid involverar kärnreaktioner atomkärnan och därmed ingår även atomnumret.
Till exempel, när partiklar (huvudsakligen måttliga neutroner) bombas på en tung, instabil atomkärna, är den kärnan bruten och ger upphov till två mindre atomkärnor, det vill säga med ett mindre antal protoner och neutroner, som frigör en kolossal mängd energi.
Kärnfusion, å andra sidan, är den motsatta processen, det är när två små och lätta kärnor förenas, med ursprung i en större och mer stabil kärna, vilket släpper ut en ännu större mängd energi.
När dessa kärnreaktioner inträffar kommer alltså nya kemiska grundämnen, eftersom atomnumren för de ursprungliga elementen skiljer sig från atomnumren för de slutliga elementen. Se till exempel nedan att klyvning av uran-235 med atomnummer 92 ger upphov till barium (Z = 56), krypton (Z = 36) och tre neutroner:

Uranium-235 kärnklyvningsreaktion
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-numero-atomico.htm


