Batteri det är ett system där kemisk energi spontant omvandlas till elektrisk energi.
År 1836 byggde den engelska kemisten och meteorologen John Frederic Daniell (1790-1845) en annan hög än den som var känd vid den tiden: Alessandro Voltas hög. I den här högen han sammankopplade två elektroder, vilka var system bestående av en metall nedsänkt i en vattenlösning av ett salt bildat av metallens katjoner.
En av elektroderna, kopparelektroden, bestod av en kopparplatta doppad i en lösning av kopparsulfat (CuSO4). Den andra elektroden var en zinkelektrod bestående av en zinkplatta nedsänkt i en zinksulfat (ZnSO4) -lösning.
Dessa två elektroder var sammankopplade av en elektrisk krets som innehöll en lampa, för om den tänds skulle det indikera uppkomsten av en elektrisk ström.
Det fanns också en saltbro mellan dem. Denna brygga bestod av ett U-format glasrör innehållande en koncentrerad vattenlösning av ett mycket lösligt salt, såsom kaliumklorid (KCl (aq)), till exempel. Rörets ändar är belagda med bomull eller agar.
Nedan har vi strukturen för denna cell eller elektrokemiska cell, som blev känd som Daniell-cellen. Kom ihåg att varje elektrod kallas en halvcell.
När kretsen är stängd tänds lampan och efter en tid zinkplattan är korroderad och minskar dess massa, medan kopparplattan är motsatt, dess massa ökar (som visas i figuren nedan). Det noteras också att det finns en ökning av koncentrationen i mol / L av Zn-jonerna2+ och en minskning av Cu-joner2+.
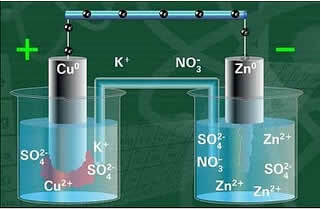
Daniels stackschema.
Varför händer det här?
Sluta inte nu... Det finns mer efter reklam;)
För att förstå, låt oss titta på reaktionerna som äger rum vid varje elektrod separat.
I zinkelektroden sker följande jämviktsreaktion:
Zn (s) ↔ Zn2+(här) + 2 och-
Detta innebär att metalliskt zink (från plattan) genomgår oxidation, det vill säga det donerar två elektroner till zink-katjonen (från lösningen) och blir Zn2 +. Motsatsen inträffar också, zink-katjonen som finns i lösningen tar emot de två elektronerna som doneras av zinken och blir metallisk zink. Därför finns det en oavbruten process av oxidation och reduktion.
Detsamma gäller kopparelektroden, som kommer att ha den globala reaktionen i dynamisk jämvikt: Cu (s) ↔ Cu2+(här) + 2 och-
Daniell insåg att om han anslöt dessa två elektroder, desto mer reaktivt skulle man donera sina elektroner till den mindre reaktiva katjonen istället för att göra detta med katjonerna i sin egen lösning. I det här fallet är zink det mest reaktiva och genomgår oxidation och donerar elektroner till koppar, därav minskningen av dess massa. Elektroden som genomgår oxidation är den negativa polen, kallad anoden. Kopparelektroden är den som genomgår reduktion, kopparkatjonen tar emot de två elektronerna från zink och kallas katoden (positiv pol).
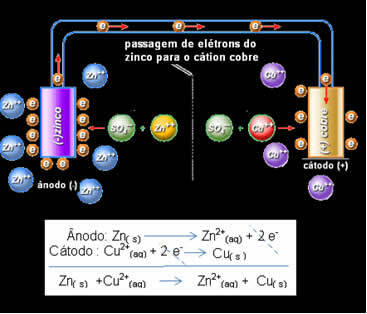
Elektronpassage och Daniels stack globala ekvation.
Ovan har vi den globala ekvationen för denna stack, som erhålls genom att lägga till de två halvreaktionerna. Dess representation eller kemiska beteckning görs enligt följande regel:

Så för Daniels stack har vi:
Zn / Zn2+// Ass2+ / ass
Av Jennifer Fogaça
Examen i kemi
Brasilien skollag
Fysikalisk-kemisk - Kemi - Brasilien skola
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Danills hög"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/pilha-daniell.htm. Åtkomst den 28 juni 2021.
