Kps är förkortningen som används för att representera löslighetsprodukt konstant, som hänvisar till produkten (multiplikation) av koncentrationer i kvantitet av materia av jonerna närvarande i en lösning.
Närhelst ett dåligt lösligt lösningsmedel tillsätts till ett lösningsmedel såsom bariumsulfat, en liten mängd en del av detta salt löses upp i vattnet, och resten ackumuleras i botten av behållaren och bildar kroppen av bakgrund. Saltet som löses upp lider dissociationsläpper ut katjoner och anjoner i vattnet.

Utfällning närvarande i en lösning med vatten och bariumsulfat
Förutom att saltet inte ger bra löslighetförändras inte mängden löst löst över tid eftersom det finns en upplösningsjämvikt mellan saltjonerna (närvarande i lösningen) och bakgrundskroppen.

BaSO upplösningsbalans4 i vatten
Kps av en löst substans
O Kps av en löst produkt är produkten av molkoncentrationerna av de deltagande jonerna. Det är alltid nödvändigt att höja jonkoncentrationen till sin respektive stökiometriska koefficient (används för att balansera ekvationen).

Upplösningsvikt för elektrolyt YDeXB
O Kps av den föreslagna jämvikten för salt YDeXB den kommer att ha koncentrationen av reagens Y (höjd till sin stökiometriska koefficient (a) och koncentrationen av produkt X (höjd till sin stökiometriska koefficient (b)).
Kps = [Y+ b]De[X-De]B
Exempel
Antag att vi förbereder en lösning med vatten och aluminiumcyanid [Al (CN)3], vilket är ett praktiskt taget olösligt salt i vatten. När detta salt tillsätts till vatten hamnar det på fenomenet dissociation.

Al (CN) elektrolytupplösningsvikt3
Så genom ekvationen av jämvikten för saltupplösning har vi det Kps kommer att multiplicera koncentrationen av aluminiumkatjonen (Al+3) höjd till exponent 1 genom koncentrationen av cyanidanjon (CN-1) höjd till exponent 3.
Kps = [Al+3]1[CN-1]3
Kps betydelser av en löst substans
När vi hittar Kps av ett visst salt blandat med vatten, vet vi också koncentrationen av var och en av jonerna i lösningen. Med dessa data kan vi bestämma rankningen av en lösning eller lösningens lösning i lösningen. Tänk på följande balans:
Sluta inte nu... Det finns mer efter reklam;)

Upplösningsvikt för elektrolyt YDeXB
Vi kan skapa följande relationer:
Om Kps = [Y+ b]De[X-De]B = 0, vi har en mättad lösning utan närvaro av fällning;
Om Kps> [Y+ b]De[X-De]B = 0, vi har en omättad lösning, det vill säga en låg mängd löst löst i lösningsmedlet (i förhållande till löslighetskoefficient);
Om Kps + b]De[X-De]B = 0, vi har en mättad lösning med en bottenkropp, det vill säga det kommer att utfällas av elektrolyten (löst ämne);
Om Kps-värdet för elektrolyten är för lågt är det ett dåligt lösligt material i lösningsmedlet.
Exempel av Kps-beräkning av en löst substans
(UERN): Lösligheten av kalciumnitrat [Ca (NO3)2] i vatten är 2,0. 10–3 mol / liter vid en viss temperatur. Kps för detta salt vid samma temperatur är:
a) 8.10–8.
b) 8.10–10.
c) 3.2.10–10
d) 3.2.10–8
Träningsdata:
Saltformel: Ca (NO3)2;
Molar saltkoncentration (löslighet): 2,0. 10–3 mol / L.
För att lösa och beräkna Kps måste du göra följande:
Steg 1: Ställ in saltupplösningsbalansen.
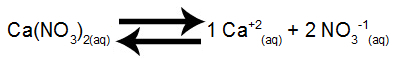
Kalciumnitratupplösningsvikt i vatten
Kalciumnitrat frisätter 1 mol kalciumkatjoner (Ca.+2) och 2 mol nitratanjoner (NO3-1).
Steg 2: Montera uttrycket av saltet Kps
Kps av detta salt kommer att vara produkten av den kalciumkatjonkoncentration som höjs till exponent 1 genom koncentrationen av nitratanjonen som höjs till exponent 2, såsom visas nedan:
Kps = [Ca+2]1.[VID3-1]2
Steg 3: Bestäm värdena för jonkoncentrationer i lösningen
För att beräkna Kps behöver vi värdena på jonkoncentrationerna, men övningen gav saltets molaritet i lösningen. För att bestämma koncentrationen av varje jon, multiplicera helt enkelt saltets molaritet med den stökiometriska koefficienten för deltagaren i reaktionen:
För kalciumkatjon:
[Här+2] = 1. 2,0. 10–3
[Här+2] = 2,0. 10–3 mol / L.
För nitratanjonen:
[VID3-1] = 2. 2,0. 10–3
[VID3-1] = 4,0. 10–3 mol / L.
Steg 4: Använd koncentrationsvärdena som finns i steg 3 i Kps-uttrycket (bestäms i steg 2).
Kps = [Ca+2]1.[VID3-1]2
Kps = [2.10-3]1.[4.10-3]2
Kps = 2.10-3.16.10-6
Kps = 32,10-9
eller
Kps = 3.2.10-9 (mo / l)
Av mig Diogo Lopes Dias
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
DAGAR, Diogo Lopes. "Vad är Kps?"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kps.htm. Åtkomst den 27 juni 2021.
Vad är kemi?

Förstå vad Kp är, jämviktskonstanten i termer av tryck, och vet hur man får det genom att använda tryck partier av alla gaser som finns i en kemisk jämvikt, som kan finnas i atmosfärer (atm) eller millimeter kvicksilver (mmHg). Klicka här och ta reda på mer om detta ämne!