Du Kolväten är sammansatta bildade av kol (C) och väte (H). Flexibiliteten hos kol, som är huvudelementet i dessa föreningar, gynnar förekomsten av en enorm mångfald av strukturer Därför kan vissa egenskaper, såsom smältpunkt och kokpunkt, skilja sig mellan kolväten.
De är mestadels molekyler apolar, med styrkas intermolekylär inducerad dipoltyp och densitet mindre än De från vatten. Identifieringen av dessa föreningar kan göras genom nomenklaturen, som följer reglerna som fastställts av International Union of Pure and Applied Chemistry (Iupac).
Läs också: Kol - ett av de vanligaste elementen i universum
Egenskaper hos kolväten

Polaritet: kolväten utan närvaro av heteroatomer är apolar.
Intermolekylära krafter: bindningarna mellan molekylerna i ett kolväte är av typen inducerad dipol.
smältpunkt och ochkokande: de varierar beroende på molekylens storlek, funktion och strukturella organisation.
fysiskt tillstånd: under normala temperatur- och tryckförhållanden är kolväten med fyra eller färre kolatomer i gasform. De med 5 till 17 kol är i flytande tillstånd och kolväten med mer än 17 kol är fasta ämnen.
Densitet: är mindre än densitet vatten, dvs. mindre än 1,0 g / cm ^.
Reaktivitet: alifatiska och omättade kolväten är dåligt reaktiva; omättade föreningar är mer benägna att reagera med andra molekyler, och cykliska kolväten med upp till fem kol är mycket reaktiva.
Klassificering av kolväten
Kolvätena kan klassificeras av kedjans strukturella organisation och av anläggningarna.Omättnad är närvaron av dubbel (er) eller trippelbindning mellan kol, är förekomsten av pi-typanslutningar (π). redan den grenar de är som "grenar" fästa vid en större kolvätekonstruktion. Cykliska kedjor kan också innehålla grenar och / eller omättningar - den strukturella organisationen av slutna kolväten bildar polygoner som kvadrat, triangel, hexan, bland andra.
När det gäller arrangemanget av atomer kan ett kolväte ha en normal eller grenad kedja.
→ C-kolvätenormal, linjär eller rak linje: den med en sträng som bara har två ändar.

→ C-kolvätehatar grenad: den med en kedja som har mer än två ändar. För att veta var och vad grenarna är är det viktigt att välja huvudkedjan korrekt. Huvudkedjan måste innehålla alla omättningar och heteroatomer (om sådana finns) såväl som det största antalet sekventiella kol. Kol som inte ingår i huvudkedjan är grenar.
Exempel:

Med avseende på dess "tillslutning" kan ett kolväte ha en sluten, öppen eller blandad kedja.
→ Kedjekolvätens stängd eller cyklisk: de med kedjor i vilka atomerna organiserar sig och bildar en cykel, en polygon eller en aromatisk ring (sluten kolväte med alternerande omättnader). Har inte lösa ändar om det inte finns en gren. Varje toppunkt på polygonen representerar ett kol och dess respektive vätebindningsmedel.
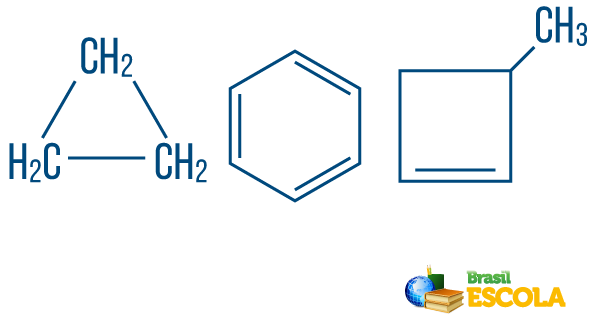
→ Öppen kedja eller acykliska kolväten: är de med kedjor som har minst två ändar.

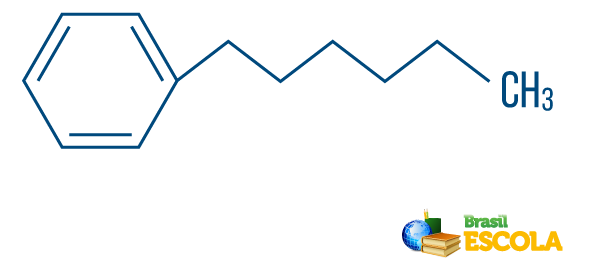
→ Kolväte av blandad sträng: bildas av en ring eller cyklisk kedja fäst vid en linjär del; den har åtminstone ena änden.
Läs också: Aromatiska kolväten - exempel och egenskaper
Nomenklatur för kolväten
För varje typ av kolväte finns en namnregel fastställd av Iupac. Nomenklaturen för dessa föreningar görs enligt följande:
1: a delen: plats och namn på filial (er) (om någon)
2: a delen: termen gäller cykel om föreningen är en sluten kedja, men om den är en alifatisk (öppen) kedja, är det inte nödvändigt;
3: e delen: prefix som anger hur många kol som finns i huvudkedjan;
4: e delen: plats och infix som indikerar typen av omättnad i molekylen;
5: e delen: suffix ”o” som är riktigt för kolväten.
Om molekylen har en öppen struktur, utan förgrening, kommer nomenklaturen att börja i del 3.
Följande tabell visar den information som krävs (prefix, infix och suffix) för kolvätenomenklatur i allmänhet. O prefix varierar med antalet kol; O infix, beroende på antalet omättningar; det är ändelse“O" avser föreningar av kolvätetyp.
Prefix |
Infix |
Ändelse |
||
1 kol |
träffade- |
Endast enstaka samtal |
-ett- |
-O |
2 kol |
et- |
|||
3 kol |
stötta- |
1 dubbelbindning |
-en- |
|
4 kol |
men- |
|||
5 kol |
pent- |
2 dubbelbindningar |
-dien- |
|
6 kol |
hex- |
|||
7 kol |
hept- |
1 trippelbindning |
-i- |
|
8 kol |
okt- |
|||
9 kol |
ej- |
2 trippel länkar |
-din- |
|
10 kol |
bestämma |
Det första steget i att upptäcka nomenklaturen för en organisk förening är identifiera huvudkedjan av kol, som måste innehålla omättningarna och så många sekventiella kol som möjligt. Efter att ha identifierat huvudkedjan, kol måste räknas upp - starta räkningen från sidan närmast grenarna och omättnaderna (om sådana finns). DE lokalisering kommer att vara antalet kol där förgreningen eller omättningen finns. Ibland finns det bara en möjlig plats för en radikal eller dubbel eller trippelbindning, så det är inte nödvändigt att uttrycka placeringen av det kopplande kolet i nomenklaturen.

DE nomenklatur för grenar kommer att ges av antalet kol i varje, plus avslutning linje eller ll. När det finns mer än en gren används alfabetisk ordning.
Se exemplen nedan:
→ Exempel 1
CH3 - CH2 - CH3 → Propan
1: a delen: prefixet “stötta-”Anger att kedjan har tre kol.
2: a delen: infixen "-ett-”Signalerar att molekylen bara gör kopplingar av typen sigma eller enkelt.
3: e delen: suffixet "-O”Är karaktäristiskt för kolväten.
→ Exempel 2
CH2= CH-CH2-CH3 → But-1-en
I kolväten med omättnad är det nödvändigt att nummerera och lokalisera kolet i vilket paret finns, och numreringen måste vara så liten som möjligt. För detta måste kolantalet börja med den sida som är närmast dubbelbindningen.
1: a delen: "men-" indikerar att det finns fyra kol i kedjan.
2: a delen: "1-en" avser omättnad belägen mellan kol 1 och 2.
3: e delen: "-O" är det karakteristiska suffixet för kolväten.
→ Exempel 3

1: a delen: "3-etyl" signalerar att det finns en tvåkolig gren på kol 2.
2: a delen: "-pent-" indikerar förekomsten av fem kol i huvudkedjan.
3: e delen: "-ett-" är infixen som tillämpas på omättade kedjor (inga dubbla eller trippelbindningar).
4: e delen: "-O" är det karakteristiska suffixet för kolväten.
→ Exempel 4
För kedjor med mer än en gren, placera radikalerna i nomenklaturen i alfabetisk ordning. Om det finns grenar och omättningar i samma molekyl bör räkningen av kol i huvudkedjan göras på ett sådant sätt att summan av platsnumren är så liten som möjligt.
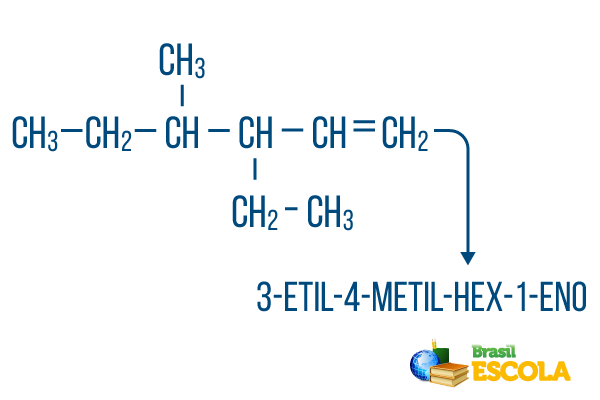
Huvudkedjekolantalet gjordes från vänster till höger, och summan av siffrorna för omättnad och grenläge är: 1 + 4 + 3 = 8. Om kolantalet hade varit från höger till vänster skulle den sammansatta nomenklaturen vara 4-etyl-3-metyl-5-en, vars summa av platser skulle vara: 4 + 3 + 5 = 12, vilket är större än den andra hypotesen, så den ska inte användas.
1: a delen: 3-etyl-4-metyl hänvisar till radikalerna i alfabetisk ordning och deras respektive platser.
2: a delen: hex- betyder att det finns 6 kol i huvudkedjan.
3: e delen: 1-sv indikerar närvaron av en dubbelbindning på kol 1.
4: e delen: "-O" är det karaktäristiska suffixet för kolväten.
→ Exempel 5
För slutna strängar gäller namngivningsreglerna, men ordet cykel startar namnet på föreningen, vilket indikerar att det är ett slutet eller cykliskt kolväte.
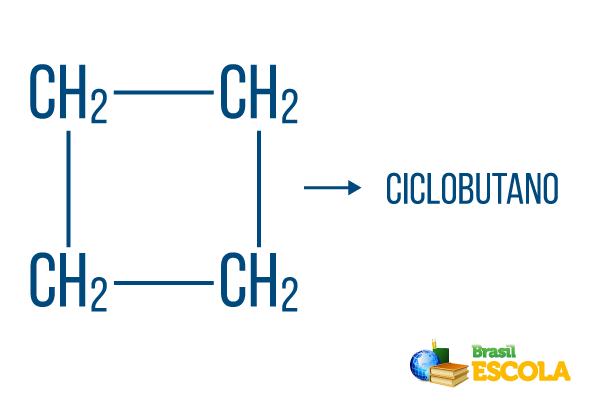
1: a delen: cykel- indikerar att det är en sluten sträng.
2: a delen: -men- betecknar förekomsten av fyra kol i kedjan
3: e delen: -Oär det karakteristiska suffixet för kolväten.
Läs också: Klassificering av kolkedjor
Typer av kolväten
Kolväten kan delas in i alkaner, alkener, alkyner och alkadiner - som klassificeras som enligt upprättandet av kedjan (dubbel (er) eller trippelbindningar) - och cyklaner, som är kedjorna stängd.
→ Alkaner: är kolväten som inte har omättnad. Den allmänna formeln för alkaner är CNejH2n + 2, och den Nejomenklatur den är sammansatt av prefix + ett + O.
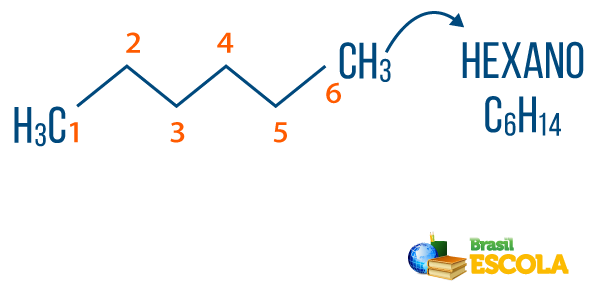
Du alkaner finns i naturen, som gas metan (CH4), som släpps ut av djur och produceras i nedbrytningsprocesser, liksom i raffinaderier och petrokemisk industri. Föreningar som propan (Ç3H7), butan (Ç4H10), som utgör vår matlagningsgas (LPG) och oktan (Ç8H18), som finns i bilbränsle, är biprodukter från Petroleum.

→ alkener eller alkener: är kolkedjor som har en omättnad, en dubbelbindning. Dess allmänna formel är CNejH2n, och din Nejomenklatur den är sammansatt av Prefix + en + o.

O etylengas (Ç2H4), som används i jordbruket för att påskynda mogningen av frukt, tillhör funktionen alken. Föreningen används också vid produktion av råmaterial polyeten, som används vid tillverkning av plastredskap.
→ Alkynes eller acetylen: kolväten med en trippelbindning. Dess allmänna formel är CNejH2n - 2. DE nomenklatur den är sammansatt av prefix + in + o.

O acetylen eller etin (C2H2) är en gas med alkynfunktionen som används i svetsar och metallskärningar. Denna förening kan nå temperaturer upp till 3000 ° C, vilket gör att reparationer kan utföras på fartygets nedsänkta delar.

→ alkadiener eller diener: kolkedjor med två omättningar, det vill säga två dubbelbindningar mellan kol. Den allmänna formeln för denna funktion är C.NejH2n - 2. Inse att det är samma formel som alkyner, vilket betyder att det kan hända isomeri mellan föreningar (samma molekylformel för olika föreningar).
Nomenklaturen för en alkadien består av Prefix + dien + o.
Exempel:

→ Kolväten med slutna kedjor: molekylerna organiserar sig på ett cykliskt sätt, tenderar att bilda en polygon och, som i öppna kedjor, kan det finnas etableringar och / eller förgreningar. Cykloner, cyklener, cykliner och bensener är kolväten med slutna kedjor.
Cykloner eller cykloalkaner: cykliska kedjor som endast består av enkelbindningar. Dess allmänna formel är CNejH2n. Nomenklatur: ciclo + prefix + an + o.
Cykler eller cykloalkener: stängda kolvätekedjor med en anläggning. Dess allmänna formel är CNejH2n-2. Nomenklatur: çiclo + prefix + sv + O.
-
Cykliner eller cykloalkiner: slutna kedjor med kolväten med närvaron av två dubbelbindningar. Dess allmänna formel är CNejH2n-4. Nomenklatur: çiclo + prefix + in + o.
bensener
Bensen är en typ av kolväte med sluten kedja med sex kol där obligationerna varierar mellan enkel och dubbel. Dessa föreningar är toxisk och mycket cancerframkallande, används som organiska lösningsmedel i kemiska processer.
För att kolväten ska anses vara aromatiskt måste det finnas minst ett bensenring, som är mycket reaktivt, därför utsatt för två eller flera ersättare, som vi ser här som förgreningar. När det finns två länkaradikaler kommer vi att ha specifika namn för varje positionspar.
Radialer på 1,2 kolbensen → orto
Radikaler vid 1,3 kolbensen bensen → mål
Radialer på kol1,4 av bensen → för
Annomenklatur för en aromatisk förening görs enligt följande:
1: a delen: positionering av liganderna (ortho, mål eller till).
2: a delen: namnet på radikalen eller radikalerna fästa vid bensen (metyl, etyl, propyl ...). Namnet på radikaler följer andra kolväte.
- 3: e delen: -Bförgifta, vilket är den karakteristiska termen för aromatiska kolväten.
Exempel:
→ Orto-dimetyl-bensen

1: a delen: Orto- indikerar att radikalerna är placerade på kol 1 och 2.
2: a delen: -dimetyl- avser de två radikalerna, båda med ett kol.
3: e delen: -bensen är den karakteristiska termen för aromatiska kolväten.
→ Orto-etyl-metyl-bensen
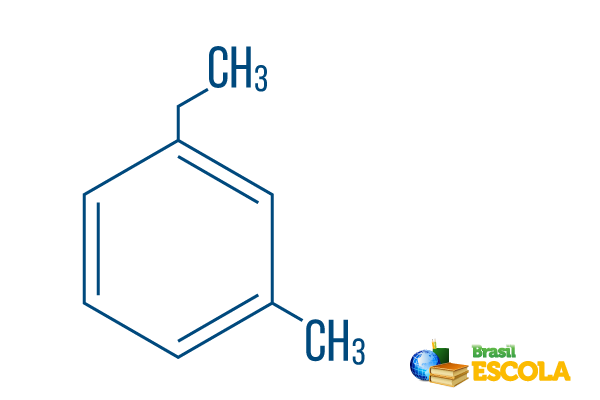
1: a delen: måh- indikerar att radikalerna är placerade på kol 1 och 3.
2: a delen: etyl-metyl- avser mängden kol i varje radikal, var etyl De tvåkolgren och metyl förgrening med ett kol - placerad i nomenklaturen i alfabetisk ordning.
3: e delen: -bensen är den karakteristiska termen för aromatiska kolväten.
→ para-dietyl-bensen
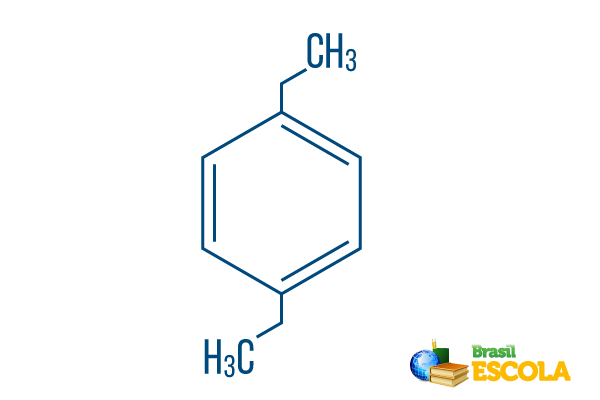
1: a delen: Pplog- indikerar att radikalerna finns på kol 1 och 4 i bensen.
2: a delen: -dietyl- hänvisar till två radikaler av typen etyl, det vill säga två grenar med två kol vardera.
3: e delen: -bensen är den karakteristiska termen för aromatiska kolväten.
Läs också:Upptäckt av bensenstrukturen
lösta övningar
(Unesp) - Oktan är en av de viktigaste beståndsdelarna i bensin, som är en blandning av kolväten. Molekylformeln för oktan är:
a) C8H18
b) C8H16
c) C8H14
d) C12H24
e) C18H38
Svar: bokstav a). Analys av sammansatt nomenklatur oktan, det är en alkan, det vill säga en molekyl som endast består av enstaka bindningar. Om den allmänna formeln för alkaner är CNejH2n + 2När vi ersätter "n" med åtta, vilket är mängden kol i huvudkedjan - och unikt i detta fall - kommer vi att ha att molekylformeln för oktan är C8H18.
(UFSCar-SP) - Tänk på följande uttalanden om kolväten.
I) Kolväten är organiska föreningar som endast består av kol och väte.
II) Endast rakkedjiga omättade kolväten kallas alkener.
III) Cykloalkaner är mättade alifatiska kolväten med den allmänna formeln CnH2n.
IV) Är aromatiska kolväten: brombensen, p-nitrotoluen och naftalen.
Följande påståenden är korrekta:
a) Endast I och III.
b) Endast I, III och IV.
c) Endast II och III.
d) Endast III och IV.
e) Endast I, II och IV.
Svar: Bokstav a).
II - Alkener är föreningar med dubbelbindning, det vill säga omättade, men de kan ha förgreningar i sin kedja, utan att vara exklusiva linjära.
IV - Brometobensen- och p-nitrotoluenföreningarna tillhör andra organiska funktioner.
av Laysa Bernardes
Kemilärare
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/hidrocarbonetos.htm


