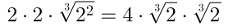DE formation entalpi, även kallad standardbildningens entalpi, eller standardbildningsvärme, är beräkningen av värmen som frigörs eller absorberas vid bildandet av 1 mol av ett ämne från enkla ämnen, i standardtillstånd.
Det är omöjligt att beräkna det absoluta värdet av entalpierna för varje ämne, men det är möjligt att beräkna variationen i entalpi som uppstår i reaktionen med hjälp av en kalorimeter.
Det är nödvändigt att komma ihåg det man enades om att anta entalpi-värdet lika med noll för enkla ämnen i standardtillståndet. Således, om vi vill ta reda på vad som är entalpin för bildandet av ett ämne, behöver vi bara veta värdet av entalpi av dess bildningsreaktion från enkla ämnen.
Till exempel vill vi hitta entalpi av 18 gram vatten, vilket motsvarar 1 mol, eftersom dess molära massa är 18 g / mol. För att göra detta behöver vi först reaktionen för att bilda vatten från enkla ämnen, som visas nedan:
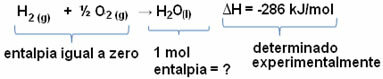
Observera att värdet av entalpiändringen som inträffade i denna reaktion bestämdes experimentellt med hjälp av en kalorimeter och är lika med -286 kJ / mol.
Formeln som beräknar denna entalpiförändring (ΔH) är:
AH = HProdukter - HReagenser
Eftersom vi redan känner till värdet av AH och att reaktanternas entalpi är lika med noll (eftersom de är enkla ämnen i standardtillståndet) kan vi sedan dra slutsatsen att entalpivärdet på 1 mol vatten är lika med entalpiförändringen av bildningsreaktionen, eftersom det är den enda produkten av reaktionen, som visat vrål:
AH = HProdukter - HReagenser
-286 kJ / mol = HH2O - (HH2 + H1/2 O2)
-286 kJ / mol = HH2O - 0
HH2O = - 286 kJ / mol
Denna typ av entalpi, uppnådd från entalpi av enkla ämnen i standardtillstånd, är därför standardbildningens entalpi (AH0).
Nu finns det många ämnen som inte bildas direkt av en enda reaktion, såsom vatten. I sådana fall kan bildningens entalpi beräknas från reaktionens entalpi-variation.
Till exempel NH4Cl bildas genom följande reaktion:
NH3 + HCl → NH4Cl AH = -176 kJ / mol
Observera att ingen av reaktanterna är en enkel substans, så vi kan inte tilldela dem en entalpi på noll. Vi behöver veta entalpierna för bildning av vart och ett av reagensen, eftersom dessa bildas av reaktioner mellan enkla ämnen:
NH3: Ah = -46 kJ / mol
HCl: Ah = -92,4 kJ / mol
Att lägga till dessa två entalpier tillsammans får vi värdet av reaktanternas entalpi och vi kan hitta entalpi av NH4Cl:
HR = HNH3 + HHCl
HR = (-46 + (-92,4) kJ / mol)
HR = -138,4 kJ / mol
Ersätter i formeln:
AH = HProdukter - HReagenser
-176 = HNH4Cl - ( -138,4)
HNH4Cl = - 176 - 138,4
HNH4Cl = -314,4 kJ / mol
I det här fallet summerade vi direkt värdena på reaktantbildningsenthalpierna eftersom reaktionsförhållandet bara var 1 mol. Om mängden mol är annorlunda i andra reaktioner kommer det emellertid att vara nödvändigt att först multiplicera entalpin för bildning av reaktanten med antalet mol.
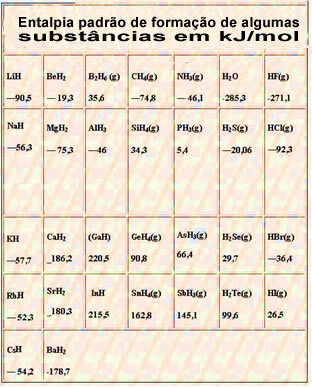
Nedan följer en tabell med standard entalpi för bildning av vissa ämnen vid 25 ° C och 1 atm:
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm