“Chemical bond ”var en term som först användes av Gilbert Newton Lewis år 1920 i en artikel för att förklara varför att atomer hänger ihop för att bilda ämnen och också varför de hänger ihop över tusentals år gammal.
Atomerna för de flesta kemiska grundämnen som hittills varit kända och listade i det periodiska systemet visas inte i isolerad form i naturen. De flesta material som finns i våra dagliga liv är ämnen som kan vara enkla (bestående av atomer av endast en typ av kemiskt grundämne) eller kompositer (har atomer med två eller flera kemiska element många olika).
Detta beror på att atomer har förmågan att göra kemiska bindningar med andra atomer, som kan vara samma element eller olika element. Dessa bindningar är så starka att utan något yttre inflytande, i de flesta fall förblir atomerna förenade som de är.
Mind Map: Chemical Bonds

* För att ladda ner mind map i PDF, Klicka här!
Det är till exempel inte vanligt att vi hittar en fri syreatom i naturen; emellertid hittar vi flera ämnen där det verkar fäst vid andra atomer. Ett exempel på en enkel substans är syrgas där varje molekyl bildas av två bundna syreatomer (O
2); medan ett exempel på en sammansatt substans är vatten, där varje molekyl har två väteatomer bundna till en syreatom (H2O).De enda elementen som finns stabilt isolerade i naturen är ädelgaser, det vill säga elementen i familj 18 i det periodiska systemet (He, Ne, Ar, Kr, Xe och Rn). Alla dessa element har gemensamt det faktum att de har åtta elektroner i det sista elektronskalet (valenslager), med undantag av helium (He), som bara har ett elektronskal (K-lager) och därför rymmer två elektroner, vilket är det maximalt möjliga antalet elektroner i det lager.
Således Gilbert N. Lewis och även forskaren Water Kossel kom till slutsatsen att Atomerna i de andra elementen binder till att ha åtta elektroner (eller två, om du bara har K-skalet) och stabiliseras därmed. Det skapades alltså elektronisk teori om valens, vilket indikerar hur många kemiska bindningar ett grundämnes atom skapar, baserat på den förklarade idén.
Därför, atomer gör kemiska bindningar som försöker förlora, få eller dela valensskalelektroner tills de når konfigurationen för nästa ädelgas.Denna teori kom också att kallas oktettregel.
Till exempel är syre tvåvärt eftersom det har sex elektroner i sitt valensskal. Därför måste den ta emot ytterligare två elektroner för att ha en konfiguration av ädelgasneonet (Ne), det vill säga med åtta elektroner i valensskalet, vilket i detta fall är L-skalet. När det gäller syrgas och vatten som nämns har vi följande:
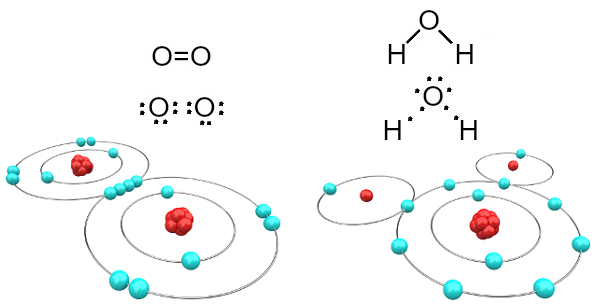
Syre- och vattenmolekyler bildade av kovalenta bindningar
Observera att i det första fallet (syrgas - O2), delar varje syreatom två elektroner, som båda har åtta elektroner i valensskalet. Detta innebär att en dubbelbindning (två bindningar samtidigt mellan två atomer).
När det gäller vatten delar var och en av de två väteatomerna en elektron med den centrala syreatomen och alla är stabila (syre har åtta elektroner i valensskalet och varje väte har två elektroner). Här görs också två enkla anslutningar.
Denna typ av kemisk bindning, där alla atomer behöver ta emot elektroner (väte, icke-metaller och halvmetaller) och i vilka elektroner delas parvis kallas kovalent bindning.
Men det finns ytterligare två typer av kemiska bindningar:
(1) jonbindning → det är den definitiva överföringen av elektroner från en atom till en annan. Denna typ av bindning sker mellan metallatomer (som har en tendens att förlora elektroner för att stanna stabila) och väteatomer, icke-metaller och halvmetaller (som har en tendens att få elektroner att stanna stabil).
Ett exempel är natriumklorid (NaCl - bordssalt) där natrium är en metall som har en tendens att förlora en elektron, medan klor är en icke-metall som har en tendens att få en elektron. Således donerar natrium(röd pil)en elektron till klor, som bildar salt, en mycket stabil substans. Sedan de examen (svart pil) joner, som är kemiska arter med motsatta laddningar (+ och -), en jon lockar en annan i närheten och joniska kluster bildas med ett stort antal joner, liksom kristallerna i bordssalt.

Bildning av natriumklorid genom jonbindning
(2) Metallanslutning → Det är en teori att metaller (såsom aluminium, guld, silver, koppar, etc.) bildas av ett kluster av neutronatomer och katjoner som hålls samman av ett slags "moln" av fria elektroner (elektroner som förlorades vid bildandet av katjoner citerad). Detta moln (eller hav) av elektroner skulle fungera som en metallbindning som skulle hålla atomerna ihop.
För mer information om dessa typer av kemiska bindningar, liksom oktettregeln, läs de relaterade artiklarna nedan.
Mind Map Av M.e Victor Ricardo Ferrreira
Kemilärare
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-uma-ligacao-quimica.htm
