Gas och ånga
Skillnaden mellan gas och ånga ges från den kritiska temperaturen. Ånga är materia i gasform, ett tillstånd som kan kondenseras med ökande tryck. Gas är inte detsamma. Det är en vätska som inte kan kondenseras med en enkel tryckökning. Detta skiljer gas från ånga.
Uppförande av gaser
Ett givet ämne i gasform är en gas om dess temperatur är högre än den kritiska temperaturen, om temperaturen är lika med eller lägre än den kritiska temperaturen är ämnet ånga.
De verkliga gaserna som vi normalt känner till, såsom helium, kväve och syre, har olika och speciella molekylära egenskaper hos var och en. Men om vi sätter dem alla vid höga temperaturer och låga tryck, börjar de visa mycket liknande beteende. I studien av gaser antas en enkel teoretisk modell, som i praktiken inte existerar, med beteenden som liknar verkliga gaser. Denna approximation blir bättre ju lägre tryck och ju högre temperatur. Denna gasmodell kallas perfekt gas.
Runt 1600- och 1800-talet var det tre forskare (Jacques Charles, Louis J. Gay-Lussac och Paul E. Clayperon), efter att ha studerat gasernas beteende, utarbetade lagar som styr beteendet hos perfekta gaser, även kallade idealgaser. De lagar som bestäms av dem fastställer reglerna för det ”yttre” beteendet hos den perfekta gasen, vilket leder till den räknar bara de fysiska mängder som är associerade med dem, vilka är: volym, temperatur och tryck.
Allmän lag om perfekta gaser
Uttrycket som bestämmer den allmänna lagen för perfekta gaser kan ses som följer:
Sluta inte nu... Det finns mer efter reklam;)
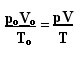
där sO, VO och tO är initialt tryck, initialvolym respektive initialtemperatur. Detta är ett uttryck som används när variablerna för en gas varierar.
boyles lag
Robert Boyle, fysiker och kemist, var den som bestämde lagen som styr de omvandlingar som en gas genomgår när dess temperatur hålls konstant. Hans lag säger att när en gas genomgår en isotermisk omvandling är dess tryck omvänt proportionellt mot den ockuperade volymen. Från denna lag får vi det hur TO = T Vi måste:
POVO = pV
Charles lag
Charles lag är lagen som styr omvandlingen av en perfekt gas till konstant volym. Dessa transformationer kallas isochoriska eller isometriska transformationer. Enligt denna lag, när en perfekt gasmassa genomgår en isokorisk transformation, är dess tryck direkt proportionellt mot dess absoluta temperatur. Matematiskt kan denna lag uttryckas enligt följande:

där sO och tO är initialtrycket respektive initialtemperaturen.
Gay-Lussacs lag
Gay-Lussacs lag är lagen som styr omvandlingen av en perfekt gas vid konstant tryck. Denna lag, trots att han bar namnet Gay-Lussac, hade redan upptäckts av fysikern och kemisten A.C. Charles. Enligt lagen är gasens volym direkt proportionell mot dess absoluta temperatur när en gas genomgår en isobar transformation. Matematiskt kan denna lag uttryckas enligt följande:

Där VO och tO motsvarar initialvolymen respektive initialtemperaturen.
Av Marco Aurélio da Silva
Se mer!!
Gastransformationer
Vet vad gastransformationer är.
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
SANTOS, Marco Aurélio da Silva. "Studie av gaser"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/fisica/estudo-dos-gases.htm. Åtkomst den 27 juni 2021.

