Atomer är oändligt små partiklar som utgör hela materien i universum. Med tiden förändrades idén om hur atomstrukturen skulle se ut enligt nya upptäckter gjorda av forskare. Du kan läsa mer om detta i textenAtommodellens utveckling.
En modell är en representation av verkligheten (inte själva verkligheten), så atommodeller är representationer av huvudkomponenter i atomen och dess struktur och förklara materiens fysikaliska och kemiska beteende. Detta görs eftersom det ännu inte är möjligt för en människa att se en isolerad atom även med ultramikroskop.
För att få en uppfattning om hur liten atomen är, vet det De Den minsta partikeln som syns i ett vanligt mikroskop innehåller över tio miljarder atomer! Atomen är så liten att, om vi sätter en miljon av dem sida vid sida, skulle vi inte nå hårets tjocklek.
Mind Map: Atom
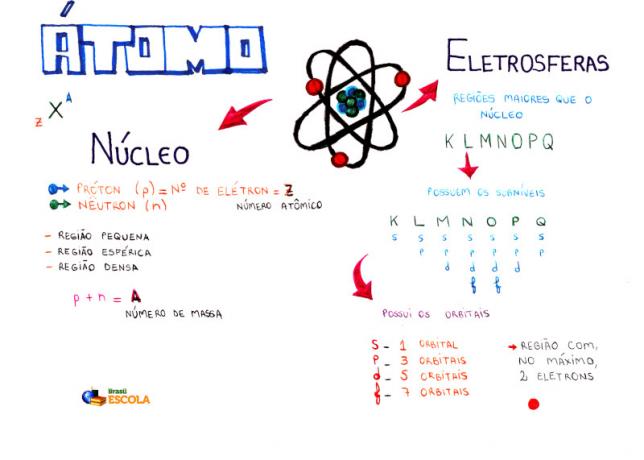
* För att ladda ner mind map i PDF, Klicka här!
Bland de atommodeller är den mest använda för närvarande i gymnasiet för att förstå atomens struktur och dess egenskaper Rutherford-Bohr-modellen. Enligt denna modell består atomens struktur av två huvuddelar:
kärna och den elektrosfär.
Två huvuddelar av en atoms struktur - elektrosfär och kärna
* Kärna: Den utgör den centrala delen av atomen, den är kompakt, massiv och mycket tät, förutom att den bildas av partiklar med större massa, som är protoner och neutroner.

Illustration av protonerna och neutronerna som utgör atomkärnan
- Protoner: de är partiklar med en positiv elektrisk laddning (relativ laddning = +1; laddning i coulomb (C) = +1,602. 10-19) och dess relativa massa är lika med 1.
Det faktum att protoner bildar kärnan och ger den en övergripande positiv laddning upptäcktes av Eugen Goldstein, 1886, genom en modifiering av Crookes ampull och några experiment. Han såg att under mycket höga spänningar uppstod utsläpp (anodstrålar - rester av gasens atomer som var inne i glödlampan och som fick elektronerna rippade av den elektriska urladdningen). Genom att placera ett elektriskt eller magnetiskt fält utanför glödlampan avböjdes dessa strålar mot den negativa polen. Detta innebar att det fanns positiva subatomära partiklar, som kallades protoner.
Senare, Ernest Rutherford (1871-1937) utförde experimentet som beskrivs i texten Rutherfords Atom, vilket ledde honom att upptäcka protonens placering: i kärnan.
- Neutroner: de är partiklar med en massa lika med protonerna (1), men som namnet antyder är de neutrala, det vill säga de har ingen elektrisk laddning.
Neutroner upptäcktes 1932 av James Chadwick (1891-1974), som insåg att kärnan i radioaktivt beryllium emitterade neutrala partiklar med en massa ungefär lika med massan av protoner (faktiskt är den något större).
Sluta inte nu... Det finns mer efter reklam;)
Kärnans diameter beror på mängden protoner och neutroner som atomen har, men i genomsnitt är den cirka 10-14 månad 10-15 m.
Atomkärnan koncentrerar praktiskt taget hela atommassan, som en mycket liten del: både protonen och neutronen är ungefär 100 000 gånger mindre än hela atomen! Som jämförelse, föreställ dig att vi förstorar kärnan i atomen i grundämnet väte (som bara har en proton) till storleken på en tennisboll, skulle den närmaste elektronen vara cirka tre kilometer från distans! Även om en atom förstorades till höjden av en byggnad med 14 våningar, skulle dess kärna vara storleken på ett saltkorn på sjunde våningen. Det är verkligen något fantastiskt, tycker du inte ?!
* Elektrosfär: Är region där elektroner roterar runt kärnan. Trots att den är en region med mycket större volym än kärnan är den praktiskt taget tom, eftersom varje elektron är 1836 gånger mindre än 1 proton (eller än 1 neutron). Det är därför som atommassan är praktiskt taget allt i kärnan. Elektroner är partiklar med negativ elektrisk laddning (-1).
Elektroner upptäcktes 1897 av Joseph John Thomson (1856-1940), skaparen av Thomson atommodell. Thomsons experiment kan ses i detalj i texten Thomsons experiment med elektriska urladdningar, men kort sagt, han använde den ovannämnda Crookes ampullen och insåg att katodstrålar alltid var lockas av den positiva polen, som bevisade att atomen hade negativa partiklar, som kallades elektroner.
Elektroner snurrar runt kärnan miljarder gånger per miljonedel av en sekund, formar atomen och får den att fungera som om den var solid.
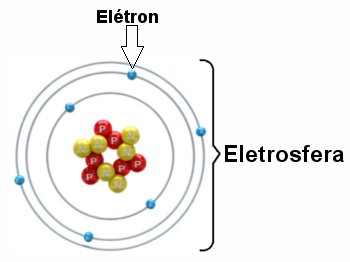
Illustration av en elektrosfär med tre elektroniska lager och elektroner som roterar runt kärnan.
Kortfattat kan vi skapa en tabell för att skilja de tre huvudsakliga subatomära partiklarna som ingår i atomens struktur:

Massa och elektrisk laddning av de tre huvudsakliga subatomära partiklarna - protoner, neutroner och elektroner
Atomerna i alla kemiska element består av dessa tre subatomära partiklar. Vad som skiljer ett kemiskt element från ett annat är mängden i vilka dessa partiklar uppträder, särskilt mängden protoner i kärnan, som kallas atomnummer. Fortsätt studera om det genom texten. Kemiskt element.
* Mind Map av mig Diogo Lopes
Av Jennifer Fogaça
Examen i kemi
Kemi
Klassificering av materia, vatten, hydrocyangas, koldioxid, ammoniak, väte, helium, ämnen enkla, sammansatta ämnen, blandningar, faser av en blandning, homogen blandning, blandning heterogen.