Så väl som cyklaner, alkener, alkyner, bland andra alkadiener lider också av samtalen tilläggsreaktioner. I texten om reaktioner i dienerkommer du att upptäcka att tillsatsreaktionerna beror på vilken typ av dien som du arbetar med. Dienerna kan i stort sett klassificeras i:
kondenserad eller ackumulerad (inget enda band mellan de två dubbelarna);
Ex: H2C = CH-CH3
konjugerad eller alternerad (endast ett enda band mellan de två dubbelarna);
Ex: H2C = CH — CH = CH2
isolerat (minst två enkelbindningar mellan de två dubblerna).
Ex: H2C = CH-CH2—CH2—CH = CH2
Diels-Alder-reaktionen utvecklades 1928 av två tyska kemister, Otto Paul Hermann Diels och Kurt Alder. Detta är en mycket viktig reaktion inom organisk kemi eftersom den tillåter:
identifiera dienkolväten;
erhålla mättade cykliska kolväten (företrädesvis cyklohexaner).
Denna organiska reaktion sker bara i alkadiener eller konjugerade eller alternerade diener och kallas tillägg 1.4. Föreningen där vi kan observera 1,4-tillsatsen på ett enklare sätt är but-1,3-dien, som visas nedan:
H2C = CH — CH = CH2
NOTERA: I denna förening har vi förekomsten av resonansfenomen, där elektronerna från de två pi-bindningarna rör sig genom kedjan. Ett par pi-elektroner börjar ockupera kedjans centrala region (mellan kol 2 och 3), medan elektronerna från den andra pi-bindningen flyttas till ett av ändkolerna. Således har vi bindningsställen på kol 1 och 4 och en dubbel mellan kol 2 och 3.

Resonans i but-2,3-dienstrukturen
Sluta inte nu... Det finns mer efter reklam;)
På Diels-Alder-reaktion, ett av reagenserna är en konjugerad dien, medan den andra är en organisk förening som kan förekomma ett samtal dubbelt mellan kolatomer. Nedan följer ett exempel på en Diels-Alder-reaktion mellan but-2,3-dien och propen:
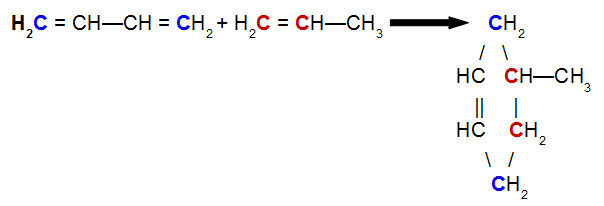
Ekvation av en Diels-Alder-reaktion av but-2,3-dien med propen
När vi analyserar ovanstående ekvation kan vi se att kol 1 och 4 (båda i blått) av but-2,3-dienbindning respektive kol 1 och 2 (båda röda) propen, vilket ger upphov till en grenad cyklen, den 4-metyl-cyklohexen. Detta beror på resonansen i but-2,3-dienmolekylen, som förskjuter en pi-bindning mellan kol 2 och 3, och brottet av pi-bindningen mellan kol 1 och 2 av propen.
OBS.²: Det är viktigt att betona att, oavsett föreningen som reagerar med den konjugerade alkadien, kommer pi-bindningen att bryta endast mellan kolatomer i kedjan. Om strukturen har pi-bindningar mellan andra atomer än kol kommer de inte att brytas. Nedan följer ett exempel på en struktur som kan reagera med en alkadien i en Diels-Alder-reaktion, vilket resulterar i att pi-bindningen bryts mellan kolbindningarna (i blått) i dubbelbindningen.
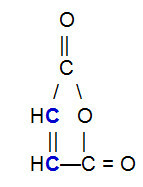
Strukturformel för maleinsyraanhydrid
Av mig Diogo Lopes Dias
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
DAGAR, Diogo Lopes. "Diels-Alder-reaktioner"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/reacoes-diels-alder.htm. Åtkomst den 28 juni 2021.
Kemi

Alkener, gas, eten, eten, plast, syntetiskt gummi, färgämnen, syntetiska tyger, sprängämnen, petroleumkrackning, polyeten, oljegas, olefiner, kolväten, kedja acyklisk koldioxid.



