Den franska kemisten Joseph Louis Proust (1754-1826) började utföra noggranna experiment som relaterade massorna av komponenterna i vissa reaktioner.
Elementen som utgör vatten är till exempel väte och syre. Proust fann att i denna vattenbildande reaktion reagerade väte alltid med syre i ett konstant och bestämt förhållande, vilket var 1: 8. Se hur detta händer nedan:

Lägg märke till att oavsett hur mycket massa av element som används, kommer andelen alltid att vara densamma.
Proust noterade att detta inte bara var fallet med vatten utan med alla andra ämnen.
15,06 g kopparsulfid (CuS) bildas exempelvis genom att reagera 10,00 g metallisk koppar (Cu) med 5,06 g svavel (S). Så om vi fördubblar mängden koppar (som går till 20,0 g), och om vi vill att all koppar ska reagera, det kommer också att vara nödvändigt att fördubbla mängden svavel till 10,12 g, med den totala bildningen av 30,12 g sulfid.
Nu, om ett belopp läggs till som inte är i proportion, kommer överskottet att bli kvar, det kommer inte att reagera. Observera detta nedan:
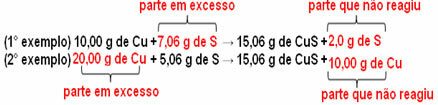
Lägg märke till att reaktionen sker endast enligt den definierade andelen. Därför drog Proust 1799 slutsatsen att när flera ämnen kombineras för att bilda en förening, görs detta alltid i ett definierat massförhållande.
Således skapade han en lag som kallas Prousts lag, Lagen om konstanta proportioner eller Lag om definierade proportioner, som anges enligt följande:

Denna lag och Lavoisiers lag (Lag om massskydd) namnges Viktlagar, eftersom de talar i massor av inblandade ämnen.
Av Jennifer Fogaça
Examen i kemi
Källa: Brazil School - https://brasilescola.uol.com.br/quimica/lei-proust-ou-lei-das-proporcoes-constantes.htm