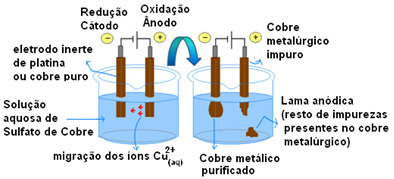
Elektrolys studeras vanligtvis inom elektrokemi som ett system som innehåller en behållare eller en elektrolytisk cell (en behållare) med en flytande substans eller i lösning, i vilken två elektroder är nedsänkta (katoden eller negativpolen och anoden eller polen positiv). Sådana elektroder är anslutna till en generator (cell eller batteri) som, när den är påslagen, leder elektricitet från en elektrod till en annan genom vätskan, vilket orsakar oxidationsreduktionsreaktioner som omvandlar elektrisk energi till energi kemi.
Men när elektrolys används i industrier är det i praktiken inte bara en elektrokemisk cell med två elektroder; utan snarare flera stora tankar kopplade i serie, som visas i öppningsbilden. Dessutom används endast en generator med tillräcklig kapacitet för service av alla dessa tankar, för om en generator användes för varje tank skulle den ekonomiska förlusten göra produktionen omöjlig industriell.
I texten Kvantitativa aspekter av elektrolys det visades att med hjälp av den elektriska laddningsformeln (Q = i. t) och genom förhållandet mellan Faraday-konstanten (96500 C) och ämnenas molära massa och med halvreaktionerna balanserad katodisk och anodisk, är det möjligt att bestämma massan av ämnet som har transformerats eller erhållits i en behållare elektrolytisk.
Detta kan också göras vid serieelektrolys. Men det finns två faktorer som måste beaktas:
1. Eftersom generatorn är en för alla elektrolytiska celler, kommer tiden (t) och intensiteten för den elektriska strömmen (i) att vara densamma för alla celler. Därför, den elektriska laddningen (Q) kommer också att vara densamma för alla celler;
2. Massan som erhålls eller transformeras i varje cell kommer att vara annorlunda, eftersom ämnena i var och en är distinkta. Detta beror till exempel på Zn-jonen2+ kräver dubbelt så många elektroner som Ag-jonen1+. Dessa massor kan beräknas med hjälp av regler på tre eller direkt med formeln nedan:
m = __M. Q__
q. 96500
På vad:
M = molmassa för varje ämne;
Q = systemets elektriska laddning;
q = jonladdningar, t.ex. om jonerna är Ag1+kommer q att vara 1.
Se ett exempel på hur du utför denna typ av beräkning:
Exempel: Det finns tre elektrolytiska kärl kopplade i serie, var och en innehållande AgNO3, CuSO4 och ZnC32. Att veta att 108 g metalliskt silver deponerades i det första behållaren, kan man dra slutsatsen att följande också deponerades:
a) 31,75 g metallisk koppar.
b) 65,4 g metalliskt zink.
Sluta inte nu... Det finns mer efter reklam;)
c) 63,5 g metallisk koppar.
d) 108 g metallisk koppar.
e) 108 g metalliskt zink.
(Atommassor: Ag = 108; Cu = 63,5; Zn = 65,4).
Upplösning:
Från massan som finns i den första elektrolytiska cellen kan vi upptäcka systemets elektriska laddning, vilket är detsamma för alla celler:
Ag+ + 1e-→ Ag
↓ ↓
1 mol 1 mol
1 mol. 96500 C 108 g (molmassa)
Q 108 g (erhållen massa)
Q = 96500C
Med detta värde i handen kan vi upptäcka massorna av andra metaller. Detta kan göras genom regeln om tre eller formeln som gavs tidigare:
- Genom regel av tre:
2: a elektrolytiska fartyget: 3: e elektrolytiska fartyget:
Röv2+ + 2e-→ Cu Zn+2 + 2e-→ Zn
↓ ↓ ↓ ↓
2 mol 1 mol 2 mol 1 mol
2. 96500 C 63,5 g 2. 96500 C 65,4 g
96500 cmRöv 96500 cmZn
mRöv = 31,75 gmZn = 32,7 g
- Med formeln: m = __M. Q__
q. 96500
2: a elektrolytiska fartyget: 3: e elektrolytiska fartyget:
mRöv = (63,5). (96500) mZn = (32,7). (96500)
2. 96500 1. 96500
mRöv = 31,75 gmZn = 32,7 g
Därför är det rätta alternativet bokstaven "a".
Av Jennifer Fogaça
Examen i kemi
Vill du hänvisa till texten i en skola eller ett akademiskt arbete? Se:
FOGAÇA, Jennifer Rocha Vargas. "Seriell elektrolys"; Brasilien skola. Tillgänglig i: https://brasilescola.uol.com.br/quimica/eletrolise-serie.htm. Åtkomst den 28 juni 2021.
Kemi

Användningar av elektrolys, elektroplätering, förnickling, förkromning, nickel, krom, katod, natrium, aluminium, klor, kaustisk soda, vätgas, magtlig elektrolys, vattenhaltig elektrolys, alkalimetaller, alkalisk jord, gas klor.
Kemi

Elektrolys, elektrolytlösningar, elektrisk ström, oxidationsreduktionsreaktioner, spontan kemisk process, kemisk process icke-spontan, transformator, artificiell transformation, industrier, alkalimetaller, jordalkalin, vätgas, gas cl