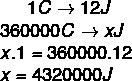Energijanotranje je vsota kinetične energije in potencial, povezan z gibanjem sestavnih atomov in molekul telesa. Notranja energija je prav tako sorazmerna z temperatura telesa. To je skalarna veličina, izmerjena v Joulih (SI) in določena kot funkcija spremenljivk, kot so pritisk (P), glasnost (V) in temperatura termodinamika (T) sistema, v Kelvinu (K).
Višja kot je temperatura telesa, večja je njegova notranja energija, zato je večja zmožnost nekega dela. Poleg tega je na primer notranja energija monoatomskih plinov podana izključno z vsoto vrednosti kinetična energija vsakega atoma plina. Pri obravnavi molekularnih plinov, kot so dvoatomni plini, moramo upoštevati molekularne interakcije in pri tem je notranja energija določena z vsoto kinetične energije molekul z potencialno energijo, ki obstaja med njimi oni.
Ne ustavi se zdaj... Po oglaševanju je še več;)
Notranja energija idealnih enoatomskih plinov
Ker med atomi idealnega monoatomskega plina ni interakcije, je njegova notranja energija odvisna izključno od dveh spremenljivk: števila molov (n) in temperature plina (T). Pazi:

U - notranja energija
št - število molov
R - univerzalna konstanta popolnih plinov
T - temperatura
V zgornji enačbi R ima modul 0,082 atm. L / mol. K ali 8,31 J / mol. K (SI). Zgornjo enačbo lahko zapišemo tudi v smislu drugih količin, kot sta tlak in prostornina. Za to si moramo zapomniti Clapeyronova enačba, ki se uporablja za idealne pline.

Če nadomestimo zgornjo enačbo za prejšnjo, bomo imeli naslednji izraz za izračun notranje energije:

Poglejtudi:Kaj je popoln plin?
Ob upoštevanju zgornjih enačb je mogoče določiti razmerje med kinetično energijo atomov idealnega monoatomskega plina in njegovo temperaturo. Za to bomo navedli, da je kinetična energija te vrste plina čistokinetika. Pazi:

m - testenine
št - število molov
M - molska masa
V mnogih primerih je zanimivo vedeti, kako izračunati variacijo notranje energije (ΔU) plina, saj ta količina kaže, ali plin je prejel ali popustil energija. Če je bila sprememba notranje energije plina pozitivna (ΔU> 0), bo plin prejel energijo; v nasprotnem primeru (ΔU <0) se bo plin odrekel delu svoje energije.

Notranja sprememba energije glede na spremembo prostornine plina.
Notranja energija za dvoatomske pline
Za idealne dvoatomske pline je notranja energija podana z nekoliko drugačno enačbo.

Notranja energija v termodinamičnih transformacijah in ciklih
Glede na 1. zakon termodinamike, se lahko notranja energija idealnega plina pri nekaterih razlikuje termodinamične transformacije, odvisno od količine toplote, ki se izmenja med okolico in sistemom, pa tudi od dela, ki ga izvaja sistem ali na njem.

V - toplota
τ - delo
Nato poglejmo obliko, ki jo ima ta zakon za nekatere posebne termodinamične transformacije.
Poglejtudi:Zgodovina termičnih strojev
→ Notranja energija: izotermična transformacija
Ob izotermična transformacija, ni temperaturnih sprememb in zato notranja energija ostane konstantna.

V tem primeru se celotna količina toplote, ki se izmenja s sistemom, spremeni v delo in obratno.
→ Notranja energija: izovolumetrična transformacija
Ob izovolumetrična transformacija, dela ni mogoče izvesti, saj je sistem zaprt v togi in neraztegljivi posodi. V tem primeru celotna količina toplote, ki se izmenjuje s sistemom, neposredno spreminja njegovo notranjo energijo.

→ Notranja energija: izobarska transformacija
Pri tej vrsti preobrazbe je sistem podvržen a stalni tlakzato je delo, ki ga opravi on ali on, mogoče izračunati analitično.

→ Notranja energija: adiabatska transformacija
V adiabatske transformacije, med sistemom in okolico ni izmenjav toplote, zato je sprememba notranje energije odvisna izključno od dela, ki ga izvaja sistem ali od njega.

Notranja energija v cikličnih procesih
V vsakem cikličnem procesu je termodinamično stanje sistema, ki ga predstavljajo spremenljivke tlaka, prostornine in temperature (P, V, T), transformirana, vendar se na koncu vrne v prvotno stanje (P, V, T), zato je sprememba notranje energije pri tej vrsti postopka vedno nična (ΔU = 0).
Poglejtudi:Ciklične transformacije
Poglejte spodnji graf, ki prikazuje tri različne termodinamične transformacije med stanji A in B.

Ker tri transformacije (I, II in III) zapustijo stanje A in preidejo v stanje B, morajo biti notranje spremembe energije enake za vse, zato:

Notranje energetske vaje
1) Dva mola idealnega dvoatomskega plina z molsko maso 24 g / mol najdemo pri temperaturi 500 K v zaprti, togi posodi s prostornino 10-3 m³. Določite:
a) Modul notranje energije tega plina v džulih.
b) Tlak, ki ga plin izvaja na stene posode.
Resolucija:
The) Ker gre za idealen in dvoatomski plin, bomo za izračun njegove notranje energije uporabili spodnjo formulo:

Na podlagi podatkov, ki so bili navedeni v izjavi o vaji, bomo rešili naslednji izračun:

B) Tlak, ki ga izvaja plin, lahko ugotovimo, ko poznamo prostornino posode:-3 m³. Za to bomo uporabili naslednjo formulo:

Jaz, Rafael Helerbrock