O atomski polmer (r) je običajno opredeljeno kot polovica razdalje med dvema jedroma sosednjih atomov, kot prikazuje spodnja slika:

atomski polmer
Atomski radij se razlikuje od enega do drugega atoma glede na svojo družino in obdobje na periodnem sistemu. Glede elementov, ki pripadajo a isti družini, se njen atomski polmer poveča, ko se atomsko število poveča., to je od zgoraj navzdol. Kajti v tem smislu pomeni, da se je od enega do drugega atoma povečala raven energije ali elektronska plast, zato se njen polmer sorazmerno poveča.
Glede elementa v istem obdobju, to je vodoravno, polmer se poveča od desne proti levi ali ko se atomsko število zmanjša. To je zato, ker imajo vsi enako število plasti, razlika je v velikosti elektronov v teh plasteh in več kot je elektronov, večja je privlačnost jedra, s čimer se zmanjša polmer atom.

Smer rasti atomskega polmera glede na družino in obdobje v periodnem sistemu
Vendar se lahko atomski polmer razlikuje glede na vzpostavljeno povezavo. Poglejmo, kako se to zgodi:
* Jonska vez: Če atom tvori a kation, se bo atomski polmer zmanjšal, ker bo jedro izgubilo enega ali več elektronov močneje privlačilo elektrone. Zdaj če tvorijo anion, torej pridobijo elektrone, se bo polmer atoma povečal, saj bo skupni naboj elektrosfere večji od skupnega naboja jedra, kar bo zmanjšalo njegovo privlačnost. Več kot elektronov pridobite ali izgubite, večje bodo razlike v velikosti žarka.
Ne ustavi se zdaj... Po oglaševanju je še več;)
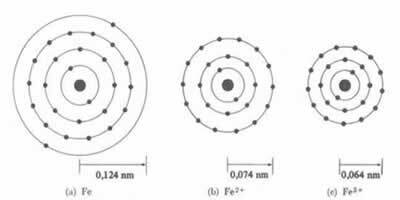
Premer ali polmer kationa je vedno manjši od premera ali polmera atoma
Tudi v seriji izoelektronski ioni, ki imajo enako količino elektronov in ravni energije, bo ion z najmanjšim atomskim številom imel večji polmer. Na primer ioni 13Al3+, 12mg2+, 11Ob1+, 9F-1, 8O2- in 7N-3, vsi imajo 10 elektronov in 2 elektronski ravni. Toda največji polmer je 7N-3, ker ima najmanjše atomsko število (Z = 7).
* Kovalentna vez: Ko dva atoma tvorita kovalentno vez, če sta atoma enaka, kot v primeru vodikovega plina (H2), lahko govorimo o kovalentnem polmeru (r), ki je polovica dolžine vezi (d), to je polovica razdalje, ki ločuje dve jedri. Čeprav, če vez tvorijo različni atomi, kot v primeru vodikovega klorida (HCl), dolžina ali razdalja (d) bo vsota kovalentnih polmerov (r1 + r2) atomov, vključenih v kovalentnost.
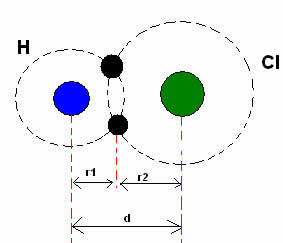
Vsota atomskih polmerov v kovalentni vezi.
Seveda se moramo zavedati, da je to vprašanje veliko bolj zapleteno, saj se lahko kovalentni polmer atoma spreminja, ko se veže na druge različne atome.
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Variacija atomskega polmera v kemičnih vezih"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/variacao-raio-atomico-ligacoes-quimicas.htm. Dostopno 28. junija 2021.