kemični element fosfor (P) spada v tretje obdobje periodnega sistema in v družino dušika (VA). Iz tega razloga njegovi atomi običajno tvorijo tri kemijske vezi doseči teorija okteta (stabilnost). V nekaterih situacijah pa fosforjev atom tvori več kot tri vezi, kar je mogoče le s pomočjo pojav hibridizacije.
Da bi razumeli hibridizacija fosforja, najprej moramo razumeti, zakaj atom tega elementa tvori tri vezi. Če želite to narediti, moramo samo spremljati vašo elektronsko distribucijo:

Elektronska distribucija fosforja
Opazimo lahko, da ima fosforjev atom v valentni plasti celotno 3s podnivo (z dva elektrona) in nepopolno 3p podnivo (vsaka od treh p podravni ima orbitalo elektrona). Spodaj imamo razporeditev elektronov v orbitalah podnivojev Fosforna valentna plast:
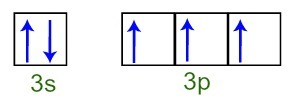
Predstavitev elektronov valentne lupine fosforjevega atoma
Ker je vsaka 3p podnivojska orbitala nepopolna, lahko atom fosforja tvori tri kemične vezi in tako doseže stabilnost.
Zdaj, ko pogledamo snov PCl5na primer prepričani smo, da je bil v tej molekuli fosfor hibridiziran, saj je vzpostavil pet povezav. Ker klor, ki spada v družino VIIA, potrebuje vez, da je stabilen in ima molekula pet atomov te element, mora vsak od njih narediti vez, zaradi česar mora fosforjev atom po drugi strani ustvariti tudi pet Povezave. Ta pojav je mogoč le z
hibridizacija (združitev nepopolnih atomskih orbital) fosforja.Ne ustavi se zdaj... Po oglaševanju je še več;)
Ko prejemajo energijo iz zunanjega okolja, se elektroni atoma fosforja vzbudijo. Kmalu zatem se eden od dveh elektronov, ki spadata v podnivo 3s, premakne na prazno orbitalo, ki je prisotna v podravni d, ki do takrat nima nobenega elektrona. Glejte spodnji diagram:
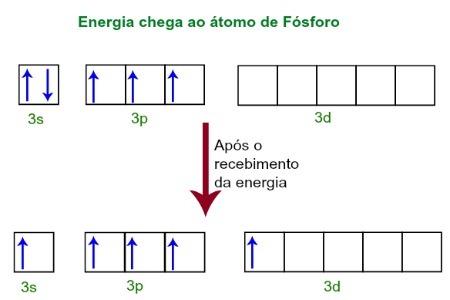
Po prejemu energije se elektroni fosforja vzbudijo in eden zavzame orbita podniveja.
V tem trenutku imamo v valenčnem sloju fosforja s orbitalo, tri p orbitale in nepopolno d orbitalo.Na koncu se teh pet orbital hibridizira, to je, da se združi, kar ima za posledico pet nepopolnih atomskih orbitalov, ki so zdaj sposobne tvoriti pet kemičnih vezi.

Hibridizacija nepopolnih atomskih orbitalov fosforja
Kot s orbitala, tri p orbitale in d orbitala, je fosforjeva hibridizacija tipa sp3d.
Jaz, Diogo Lopes Dias
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
DNI, Diogo Lopes. "Hibridizacija fosforja"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/hibridizacao-fosforo.htm. Dostopno 28. junija 2021.