Človek že od antike zanima odgovor na vprašanje o sestavi snovi.
Več oseb iz znanstvene skupnosti se je do tega opredelilo, vendar so se skrivnosti o sestavi atoma začele razkrivati šele konec 19. stoletja.
Stari filozof Levkip je denimo verjel, da je atom sestavljen iz drobnih delcev.
Po tej definiciji sta Demokrit in Dalton predlagala, da so atomski delci masivni in nedeljivi.
To dejstvo je pozneje izpodbijal Thomson, angleški fizik, ki je odkril obstoj elektrona in nato lahko potrdil idejo, ki jo je predlagal Leucipo.
Po tem odkritju je Thomson predstavil model, v katerem je atom tvoril krogla pozitivnih nabojev, znotraj jedra pa so bili elektroni.
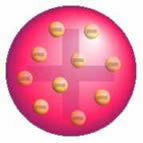
Thomson's Atom Model - V pozitivno nabiti, enakomerno porazdeljeni masni krogli,
bili bi obdani z negativno nabitimi elektroni, kot v pudingu.
Tudi po Thomsonovi teoriji je atomski model še vedno imel teoretično-eksperimentalno pomanjkljivost, ki je lahko dokazala njegovo resničnost.
O tem so še enkrat toplo razpravljali, ko je ekipa fizika Rutherforda ugotovila, da je prišlo do zelo velikega odstopanja (in nerazložljivo, v skladu s teorijo rozin pudinga), ko so nekateri radioaktivni delci alfa prešli skozi tanko plast lamele kovinski.
Po analizi in proučitvi dejstva je Rutherford prišel do zaključka, da je polmer atoma 10.000-krat večji od polmera jedra.
Z vsemi raziskavami atoma sta Rutherford in njegova ekipa leta 1911 prispela do atomskega modela, ki so ga poimenovali planetarni model atoma.

Leta 1913 je Niels Bohr razvozlal atomski model in pri svojih študijah uporabil količino delovanja, ki jo je odkril Planck. Kvantnost delovanja je bila pravzaprav odličen nadomestni znak, ki bo dokončal in razjasnil atomski model.
Bohr je učinkovito in preprosto prilagodil model, ki ga je predstavil Rutherford, in prišel do naslednjega zaključka:
Elektron pridobi energijo, ki je predstavljena skozi določeno orbito. Dovoljene orbite tvorijo ravni energije.

Avtor Talita A. angeli
Diplomiral iz fizike
Brazilska šolska ekipa
Fizika Sodobna - Fizika - Brazilska šola
Vir: Brazilska šola - https://brasilescola.uol.com.br/fisica/do-atomo-rutherford-ao-atomo-bohr.htm
