Baterija je naprava, v kateri se električni tok proizvaja iz kemične energije, ki prihaja iz reakcija oksidoredukcije, to pomeni, da ena vrsta reaktanta izgubi elektrone (oksidacija), druga vrsta pa elektrone (redukcija).
Oglejte si predstavitve reakcij oksidacije in redukcije, ki se pojavijo v katerem koli skladišču:
Oksidacija: X → in + X+
Vrsta X izgubi elektron in se spremeni v kation.
Zmanjšanje: Y.- + in → Y
Y anion- pridobi elektron in se pretvori v nevtralno Y vrsto.
Osnovni sestavni deli sklada
Osnovne komponente sklada so:
Anoda: negativna elektroda, v kateri poteka oksidacijska reakcija, to je izguba elektronov;
Katoda: pozitivna elektroda, v kateri poteka redukcijska reakcija, to je elektronski dobiček;
Elektrolitska raztopina (solni most) ali prevodni material (na primer grafitna palica): je način, s katerim elektroni, ki jih odda anoda, dosežejo katodo.
Osnove delovanja baterije
Delovanje sklada se pojavi iz naslednjih dogodkov:
1. načelo: Anodna oksidacija
Kovina v anodi, ker ima večjo težnjo k izgubi elektronov, postane kation, kot smo opazili v spodnji enačbi:
Zn → Zn2+ + 2 in
2. načelo: redukcija katode
Kationi, ki so del materiala, ki je prisoten v katodi (za primer bomo uporabili baker), pri sprejemanju elektroni iz anode se pretvorijo v kovinski baker, kot lahko vidimo v enačbi spodaj:
Ass2+ + 2e → Cu
prvi kupi
a) Baterija Alessandra Volte
Hrbet Alessandra (prvi kup v zgodovini), sestavljen leta 1800, so tvorili interkalirani kovinski diski, kot je na spodnji sliki:

Sestava, podobna Alessandrovemu Nazaj na svoj kup
Diski so bili prepleteni, ker so imeli drugačno sestavo. Ena je bila iz kovine cinka, druga pa iz bakra, vedno ločena z bombažem, namočenim v slanico (raztopino, ki jo tvorita voda in sol).
Ne ustavi se zdaj... Po oglaševanju je še več;)
B) Danielov kup
Danielov kup, sestavljen leta 1836, je bil sestavljen iz dveh polcelic, povezanih s prevodno žico in solnim mostom.
Polcelična 1: to je bila anoda, to je negativni pol akumulatorja.
Sestavljena je bila iz cinkove plošče, del te plošče pa je bil potopljen v raztopino, ki jo tvorita voda in cinkov sulfat (ZnSO4).
Polcelica 2: to je bila katoda, to je pozitivni pol baterije.
Sestavljena je bila iz bakrene plošče, del te plošče pa je bil potopljen v raztopino, ki jo tvorita voda in baker sulfat (CuSO4).
solni most
Cev v obliki črke U, ki je vsebovala raztopino, ki jo tvorita voda in kalijev klorid (KCl), ki je povezoval dve polcelici (cink in baker) in imel na obeh koncih stekleno volno.
baterije
Trenutno obstaja več modelov skladov, vendar so na splošno videti tako:
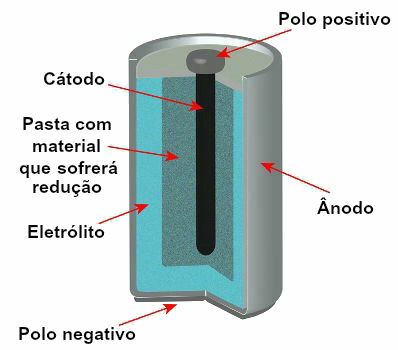
Shema, ki predstavlja model trenutnega sklada
Najbolj uporabljena modela sta tako imenovana Leclanchéjeva baterija in alkalna baterija, ki imata naslednje razlike:
The) Leclanche kup
Ima anodo, ki jo tvori kovinski cink;
Ima katodo, ki jo tvori pasta z amonijevim kloridom, vodo, škrobom in manganovim dioksidom;
Ima grafitno palico, ki služi kot prevodnik za elektrone, ki odhajajo od katode proti anodi.
B) Alkalna baterija
Ima anodo, ki jo tvori kovinski cink ali kadmij;
Ima katodo, ki jo tvorijo živosrebrni oksid, nikljev oksid in jod;
Imeti mora mešano podlago v materialu, ki tvori katodo.
Jaz, Diogo Lopes Dias
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
DNI, Diogo Lopes. "Kaj je baterija?"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-pilha.htm. Dostop 27. junija 2021.