Velika večina materialov, ki jih najdemo v naravi, v naši družbi in v telesu, niso čiste snovi, ampak v resnici mešanice dveh ali več snovi.
Čeprav se največkrat na mineralno vodo sklicujemo le kot na „vodo“, v resnici nima samo čiste snovi H2O, ker je rezultat procesa, v katerem deževnica prodre v tla in prehaja skozi različne kamnine.
Kot že ime pove, ima poleg vode tudi več raztopljenih mineralov. Če ste radovedni, da preverite oznako katere koli mineralne vode, boste videli, da je v njeni sestavi kemija stroncijevi sulfati, kalcij, natrij, kalij, natrijev bikarbonat, natrijev fluorid, med drugi.
Zemljevid uma: mešanice
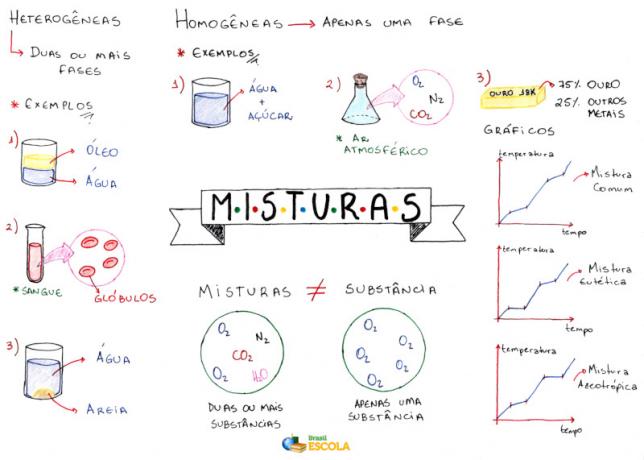
* Če želite prenesti miselni zemljevid v PDF, Klikni tukaj!
Kako je mogoče razlikovati snov od zmesi?
Spodaj prikazana destilirana voda je čista snov, ki vsebuje samo H2O:

Destilirana voda, ki se uporablja v laboratoriju
Vizualno izgleda popolnoma kot mešanica vode in soli; vendar jih je mogoče razlikovati od opredelitve mešanice. Poglej:
→ Mešanice so materiali, katerih fizikalne lastnosti niso konstantne, ampak se spreminjajo pri določeni temperaturi in tlaku.
Torej, samo izmerite fizične lastnosti, kot so tališče in vrelišče ter gostota. Če so konstantni in natančno opredeljeni, je a čista snov (pri destilirani vodi pri 4 ° C je njena gostota 1,0 g / cm33 in na morski gladini sta tališča in vrelišča 0 ° C in 100 ° C).
Če pa so predstavljene različice, gre za mešanico. Če segrejete mešanico vode in soli, da preverite vrelišče, boste to videli med prehodom iz tekočega stanja v plina, temperatura ne ostane enaka kot pri destilirani vodi, ki ostane pri 100 ° C, dokler se vsa tekočina ne spremeni para.
Zdaj obstajajo mešanice da sploh ni treba določiti njihovih fizikalnih lastnosti, da bi vedeli, da gre za mešanice, samo poglejte, kot je to pri naslednji mešanici vode in olja:

Mešanica, ki jo tvorita voda in olje
To pomeni, da obstajajo različne vrste mešanic, ki jih lahko razvrstimo v homogena in heterogena. Oglejte si vsakega:
Homogene mešanice:
So tisti, ki imajo enak videz z eno fazo (enofazna). Primeri:
fiziološka raztopina (0,9 g natrijevega klorida v 100 ml vode);
slanica (36 g soli, kot so natrijev klorid, magnezijev klorid, kalijev jodat, sredstva proti vlaženju in 100 ml vode);
hidrirani alkohol (etanol in voda);
zrak (78% dušikovega plina, 20% kisikovega plina, 2% drugih plinov in vodne pare);
jeklo (kovinska zlitina, ki jo tvori 98,5% železa in 1,5% ogljika).

Fiziološka raztopina, jeklo in formaldehid, primeri homogenih zmesi
To kažejo zgornji primeri homogene mešanice lahko so v trdnem, tekočem ali plinastem stanju. Te homogene mešanice se imenujejo rešitve in jih ni mogoče ločiti s fizikalnimi metodami, temveč samo s kemičnimi tehnikami. Da bi na primer alkohol ločili od vode, je treba izvesti postopek destilacija, ker a centrifuga ali filtracija ne bi šlo.
Poleg tega je pomembno poudariti, da morajo biti homogena tudi če gledamo pod ultramikroskop. S prostim očesom se na primer mleko in kri lahko zdita homogena, toda pod ultramikroskopom vidimo, da sta v resnici heterogena. Oglejte si sliko krvi pod ultramikroskopom in njene ločene faze po namestitvi v ultracentrifugo:
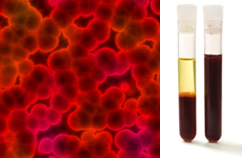
Mikroskopska slika in krvne faze
Heterogene mešanice:
So tiste, ki imajo več kot eno fazo. Primeri: voda in olje, voda in pesek, led in voda, granit, voda in železo, neraztopljena sol v vodi itd.
Sestavni deli heterogene mešanice pojavljajo se v večini primerov v različnih agregatnih stanjih in jih je mogoče ločiti s fizikalnimi metodami. Primer se zgodi, ko skuhamo kavo in trdo snov filtriramo in jo ločimo od tekočine.
A to se ne zgodi vedno, kot je prikazano v primeru olja in vode, ki pa se kljub temu, da sta tekočini, zaradi različnih polarnosti molekul.
Mentalni zemljevid Mati Victor Ricardo Ferreira
Učitelj kemije
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/tipos-misturas.htm
