Ideje o sestavi snovi (atoma) so se pojavile v stari Grčiji, približno 450 pr. a., predvsem iz Demokrita in Levcipa. Vendar pa je atom dejansko dobil znanstveni značaj šele po t.i. Daltonova atomska teorija.
THE Daltonova atomska teorija bila je temeljna za razvoj atomskega znanja, saj je drugim znanstvenikom služila kot osnova za poznavanje atoma in njegovih značilnosti.
Kdo je bil John Dalton?
John Dalton, po izobrazbi kemik, se je rodil leta 1766 v angleški Cumbriji in leta 1844 umrl v Manchestru. Že od malih nog je bilo njegovo življenje namenjeno znanstvenim raziskavam in poučevanju, tako da je poučeval ali prispeval k razvoju različnih področij znanja.
Njegova največja zapuščina kot znanstvenika pa je bil razvoj prve atomske teorije. Skozi več eksperimentov, povezanih z mešanico plinov in poznavanjem del, ki jih je predlagal Lavoisier, se je leta 1808 pojavila Daltonova atomska teorija.
Postulata Daltonove atomske teorije
Daltonova atomska teorija je temeljila na poskusih, vendar nobeden od teh poskusov ni mogel jasno razkriti atoma. Dalton je torej atom imenoval najmanjši del snovi.
Daltonova teorija predstavlja veliko več postulatov kot dokazov. Oglejte si nekatere od njih:
Atomi so masivne in sferične oblike (podobni biljardni krogli);
Atomi so nedeljivi;
Atomi so neuničljivi;
Ena kemični element gre za skupek atomov z enakimi lastnostmi (velikost in masa);
Atomi različnih kemičnih elementov imajo različne lastnosti drug od drugega;
Za njihovo razlikovanje je mogoče uporabiti relativno težo dveh atomov;
Sestavljena kemikalija nastane z isto kombinacijo različnih vrst atomov;
Z združevanjem različnih atomov nastanejo različne kemične snovi.
Predstave Daltonovega atomskega modela
Dalton je svoj atomski model poimenoval biljardna krogla, zato je s sferičnimi simboli začel predstavljati atome elementov, znanih v njegovem času.
Atomi, predstavljeni po Daltonovi atomski teoriji
Vsaka atomska predstavitev, ki ima določeno podrobnost, kaže na drugačen kemični element. Knjige in vaje na osnovni in srednji ravni didaktično predstavljajo atome le s kroglami z različnimi barvami.
Didaktična predstavitev atomov
Prispevki Daltonove atomske teorije
razumevanje Lavoisierjev zakon ohranjanja mase
Francoski kemik Lavoisier je leta 1785 trdil, da »V kemijski reakciji se masa ohrani, ker atomov ne nastane ne uniči ”. Daltonova atomska teorija je to dejstvo dokazala, saj eden od njegovih postulatov navaja, da je atom neuničljiv.
Če torej zgorevanje premoga (C) izvajamo v prisotnosti kisikovega plina (O2), bomo imeli kemično reakcijo med enim atomom ogljika in dvema atomoma kisika. Ta reakcija tvori ogljikov dioksid (CO2), ki ima popolnoma enake atome, ki so tvorili snovi pred reakcijo.
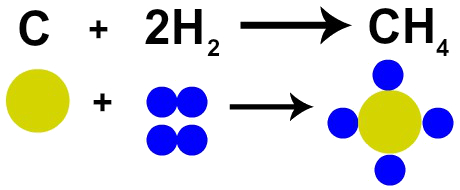
Zastopanje Lavoisierjevega zakona z Daltonovim atomskim modelom
razumevanje preproste snovi
Uporabljati Daltonov atomski model, lahko razumemo preprosto snov, torej tisto, ki ima atome enake značilnosti, ki tvori molekulo. Zato imamo atome, ki pripadajo istemu kemičnemu elementu.
V snovi F2na primer imamo dva atoma fluora, zato moramo pri predstavitvi po Daltonovi atomski teoriji uporabiti dve vrsti enakih atomov.

Preprosta predstavitev snovi po Daltonov atomski model
razumevanje sestavljene snovi
V sestavljeni snovi imamo atome različnih značilnosti, ki tvorijo molekulo. Zato imamo različne kemične elemente, ki tvorijo snov.
Snov H2O ima na primer tri atome: dva vodika in en kisik. Oglejte si njegovo predstavitev glede na atomski model Daltona:
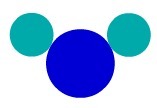
Prikaz sestavljene snovi glede na kožoDaltonov atomski model
Razumevanje mešanic
Razumevanje zmesi (združitev dveh ali več različnih snovi) skozi Daltonovo atomsko teorijo je preprosto: v isto posodo damo dve različni molekuli.

Prikaz druge zmesi Daltonov atomski model
Drugi znanstveni prispevki Johna Daltona
predstavil koncept atomska masa;
Oblikoval je zakon parcialnih tlakov plinov (Daltonov zakon);
Odkril okvaro vida, imenovano barvna slepota;
Preučeval obnašanje hlapov in plinov pri različnih temperaturah;
Ugotovil je, da se vsi plini na enak način širijo (poskušajo zasesti določeno mesto) v vesolju.
Jaz, Diogo Lopes Dias
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/teoria-atomica-dalton.htm