sol anorganski je vsaka ionska snov (ki jo tvori kation, ki ni hidronij / H+ in anion, ki ni hidroksid / OH-), ki je, ko se raztopi v vodi, izpostavljen pojavu disocijacija. V tem postopku se sprostijo prisotni kation in anion, kot je prikazano v sledi disociacijska enačba:
XY(tukaj) → X+ + Y-
Enačbe disociacije anorganskih soli vedno funkcija:
Okrajšava (aq): Označuje, da se sol meša z vodo;
Puščica: Označuje sproščanje ionov;
X+: Kation, ki se nanaša na prvo skupino ali simbol formule soli;
Y.-: Anion, ki se nanaša na skupino ali simbol za X formule soli.
Sestaviti disociacijsko enačbo soli je treba dobro poznati formulo anorganske soli, ki bo disociirana. Formula anorganske soli ima praviloma lahko naslednje značilnosti:
a) Disociacijska enačba soli s kationom X in anionom Y, na nobenem od njih pa ni zapisan noben indeks.
Naboj obeh ima različne znake in enake vrednosti, vrednost pa vedno določa anion. Na primer:
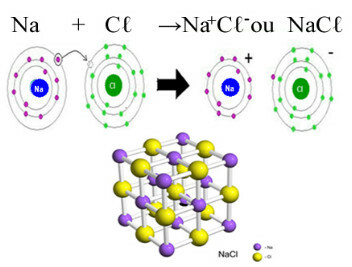
Primer 1: NaCl - natrijev klorid
Ker ima anion Cl vrednost naboja -1, ima kation Na naboj +1. Tako ione predstavlja Na+1 in Cl-1, in disociacijska enačba za to sol je:
NaCl(tukaj) → V+1 + Kl-1
2. primer: MgS - magnezijev sulfid
Ker ima S anion vrednost naboja -2, ima kation Mg naboj +2. Tako ione predstavlja Mg+2 in S-2, in disociacijska enačba za to sol je:
MgS(tukaj) → Mg+2 + S-2
b) Disociacijska enačba za sol, ki ima kation z indeksom, napisanim takoj za njo, in indeksom, napisanim za anionom.
V tem primeru je anionski naboj indeks, zapisan pred kationom, kationni naboj pa ima vrednost 1, saj kot anionski indeks ni številke. Na primer:
Primer 1: K2S - kalijev sulfid
Ker ima kation K indeks 2, naboj aniona je -2. Že kation bo imel +1 naboj ker na anionu ni zapisano kazalo. Tako ione predstavlja K+1 in S-2, in disociacijska enačba za to sol je:
K2s(tukaj) → 2K+1 + S-2
Koeficient 2 je treba postaviti levo od K, saj je v formuli za sol 2 K.
c) Disociacijska enačba soli s kationom X, za katerim ni zapisan indeks, in anionom Y, ki predstavlja element kisik z indeksom, napisanim takoj za njim.
V tem primeru je treba zanemariti indeks, zapisan za kisikom, naboj kationa in aniona pa bo imel različna predznaka in enake vrednosti, vrednost pa bo vedno določil anion. Na primer:
Primer 1: NaClO4- natrijev perklorat
Všeč mi je anion ClO4 predstavlja obremenitev -1, kation Na ima naboj +1. Torej ioni so ki jo zastopa Na+1 in ClO4-1. Enačba disociacije za to sol je:
NaClO4 (aq) → V+1 + ClO4-1
2. primer: MgCO3- Magnezijev karbonat
Všeč mi je anion CO3 predstavlja obremenitev -2, kation Mg ima naboj +2. Torej ioni so ki jo zastopa Mg+2 in ClO3-2, disociacijska enačba pa je:
MgCO3 (aq) → Mg+2 + ClO3-2
3. primer: AlPO4- Aluminijev fosfat
Všeč mi je anion po4 predstavlja obremenitev -3, kation Al ima naboj +3. Torej ioni so ki jo zastopa Al+3 in PO4-3, in disociacijska enačba za to sol je:
AlPO4 (aq) → Al+3 + PO4-3
d) Disociacijska enačba soli, ki ima kation X z indeksom, napisanim takoj za njim, in anionom Y, ki prikazuje element kisik, in indeksom, napisanim takoj za njim.
V tem primeru je kationski indeks anionski naboj, kationni naboj pa je enak 1, saj obstaja le indeks takoj za kisikom. Na primer:
Primer 1: K2SAMO3- kalijev sulfit
Ker ima kation K indeks 2, naboj aniona je -2. Že kation K ima +1 naboj ker na anionu po 3 ni indeksa, ki pripada kisiku. Tako ione predstavlja K+1 in tako3-2, in disociacijska enačba za to sol je:
K2SAMO3 (aq) → 2K+1 + OS3-2
Koeficient 2 je treba postaviti levo od K, saj je v formuli za sol 2 K.
2. primer: Au3BO3- Zlati borat I
Ker ima Auction indeks 3, naboj aniona BO3 é -3. Že kation ima +1 naboj ker na anionu po 3 ni indeksa, ki pripada kisiku. Tako ione predstavlja Au+1 in Bo3-3, in disociacijska enačba za to sol je:
Ne ustavi se zdaj... Po oglaševanju je še več;)
Au3BO3 (aq) → 3. avg+1 + BO3-3
Koeficient 3 je treba postaviti levo od Au, saj je v formuli za sol 3 Au.
3. primer: Ass4P2O6- Bakrov hipofosfat I
Ker ima bakreni kation (Cu) indeks 4, ima naboj aniona je -4. že kation ima +1 naboj ker na anionu po 6, ki pripada kisiku, ni zapisan indeks. Tako ione predstavlja Cu+1 in P2O6-4, in disociacijska enačba za to sol je:
Ass4P2O6 (aq) → 4 Cu+1 + P2O6-4
Koeficient 4 je treba postaviti levo od bakrenega kationa (Cu), saj so v formuli soli 4 bakreni kationi.
e) Disociacijska enačba soli s kationom X, za katerim ni zapisan indeks, in aniona Y v oklepajih s pisanim indeksom.
V tem primeru je indeks za oklepaji aniona naboj kationa, naboj aniona pa 1, ker po kationu ni zapisanega indeksa. Na primer:
Primer 1: Mg (ClO2)2- Magnezijev klorit
Kot anion ClO2 predstavlja indeks 2 za oklepaji, Naboj Mg kation je +2. že anion ima naboj -1 ker po kationu ni zapisano kazalo. Tako ione predstavlja Mg+2 in ClO2-1, in disociacijska enačba za to sol je:
Mg (ClO2)2 (aq) → Mg+2 + 2 ClO2-1
Koeficient 2 je treba postaviti levo od ClO2, saj je v formuli soli 2 ClO2.
2. primer: Al (NC)3- Aluminijev izocianid
Ker ima NC anion za oklepaji indeks 3, Al kation znaša +3. že anion ima naboj -1 ker na kationu ni zapisano kazalo. Tako ione predstavlja Al+3 in NC-1, in disociacijska enačba za to sol je:
Al (NC)3 (aq) → Al+3 + 3 NC-1
Koeficient 3 je treba postaviti levo od NC, saj je v formuli soli 3 NC.
3. primer: Ti (MnO4)4- Titanov permanganat IV
Kot anion MnO4 predstavlja indeks 4 za oklepaji, naboj Ti kation je +4. že anion ima naboj -1 ker na kationu ni zapisano kazalo. Tako ione predstavlja Ti+4 v4-1, in disociacijska enačba za to sol je:
Ti (MnO4)4 (aq) → Ti+4 + 4 MnO4-1
Koeficient 4 je treba postaviti levo od MnO4, saj je v formuli soli 4 MnO4.
f) Disociacijska enačba soli, ki ima kation X z indeksom, napisanim takoj za njim, in anion Y znotraj oklepajev z zapisanim indeksom.
V tem primeru je indeks za oklepaji aniona naboj kationa, indeks po kationu pa naboj aniona. Na primer:
Primer 1: Al2(SAMO4)3- Aluminijev sulfat
Kot anion SO4 predstavlja indeks 3 za oklepaji, Al kation znaša +3. že anion ima -2 naboja ker je za kationom zapisan indeks 2. Tako ione predstavlja Al+3 in tako4-2, in disociacijska enačba za to sol je:
Al2(SAMO4)3 (aq) → 2 Al+3 + 3 SO4-2
Koeficient 3 je treba postaviti levo od SO4 in koeficient 2 levo od Al, saj imamo v formuli za sol 2 Al in 3 SO4.
2. primer: Ti2(Ç2O4)4- Titanov oksalat IV
Kot C anion2O4 predstavlja indeks 4 za oklepaji, Tiatorski naboj je +4. že anion ima -2 naboja ker je za kationom zapisan indeks 2. Tako ione predstavlja Ti+4 in C.2O4-2, in disociacijska enačba za to sol je:
Ti2(Ç2O4)4 (aq) → 2 Ti+4 + 4 ° C2O4-2
Koeficient 4 je treba postaviti levo od C2O4 in koeficient 2 levo od Ti, saj imamo v formuli soli 2 Ti in 4 C2O4.
3. primer: Vera4(Str2O6)3- hipofosfat železa III
Tako kot anion P2O6 predstavlja indeks 3 za oklepaji, Strošek Fe kation je +3. že anion ima -4 naboja ker je indeks 4 zapisan takoj za kationom. Tako ione predstavlja Fe+3 in P2O6-4, in disociacijska enačba za to sol je:
Vera4(Str2O6)3 (aq) → 4 Fe+3 + 3P2O6-2
Koeficient 3 je treba postaviti levo od P2O6 in koeficient 4 levo od Fe, saj imamo v formuli za sol 4 Fe in 3 P2O6.
Jaz, Diogo Lopes Dias