Elektronska porazdelitev elektronov atoma v nevtralnem ali osnovnem stanju se običajno izvaja z Paulingov diagram, prikazano spodaj:
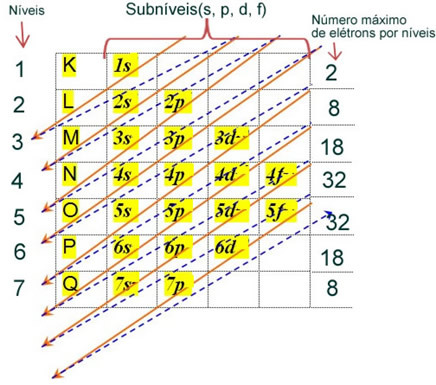
Podrobna pravila za to distribucijo najdete v naslednjih dveh besedilih na naši spletni strani: “Elektronska distribucija elektronov"in"Pravila elektronske distribucije”.
Elektronska porazdelitev ionov deluje sprva na enak način kot za atome v nevtralnem stanju; z samo eno razliko. Ker je ion atom, ki je pridobil ali izgubil elektrone, moramo to upoštevati in narediti naslednje:

Pomembno opažanje je: sprememba je narejena na najbolj zunanjem podnivu in ni najbolj energična.
če je ion a kation, moramo odstrani elektrone da je izgubil. Oglejmo si primer:
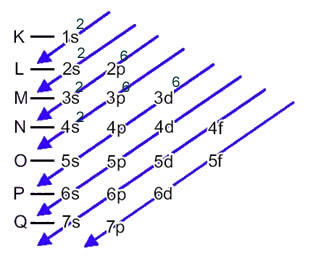
Atom železa (atomsko število = 26) ima naslednjo elektronsko porazdelitev v podnivih v energijskem vrstnem redu: 1s2 2 s2 2p6 3s2 3p6 4s2 3d6. Kar zadeva elektronske sloje, imamo: K =2; L = 8; M = 14; N = 2.
Ta porazdelitev je prikazana v spodnjem Paulingovem diagramu:
Ko atom železa izgubi 2 elektrona, se spremeni v kation Fe.
2+. Torej, pri vaši elektronski distribuciji moramo odstrani 2 elektrona iz zadnje lupine(N) in ne z najbolj energijske podravne, kot je prikazano spodaj: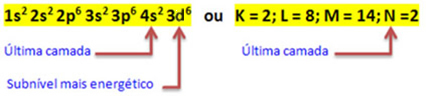
Tako elektronska distribucija kationa Fe2+ podaja:
1s2 2 s2 2p6 3s2 3p6 3d6 ali K = 2; L = 8; M = 14
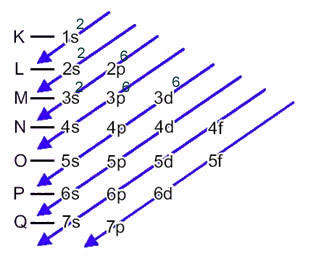
Zdaj, če moramo izvesti elektronsko distribucijo a anion, moramo dodajte elektrone, ki jih je prejel.Oglejte si, kako je to storjeno v naslednjem primeru:
Žveplov anion (16s2-) nastane iz žveplovega atoma (16S) z dobičkom 2 elektrona, kot kaže polnjenje 2-. Njegova osnovna elektronska distribucija je podana z:
1s2 2 s2 2p6 3s2 3p4 ali K = 2; L = 8; M = 6
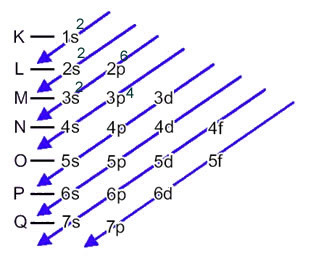
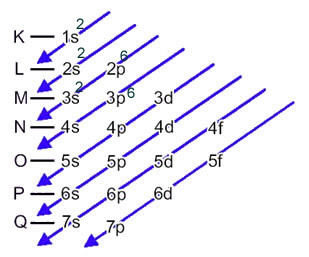
V tem primeru je zadnji podnivo enak nivoju energije 3p. Torej mu dodamo dva elektrona žveplovega aniona:
1s2 2 s2 2p6 3s2 3p6 ali K = 2; L = 8; M = 8
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/distribuicao-eletronica-ions.htm
