THE konstanta hidrolize (Kh) se nanaša na a kemično ravnotežje ugotovljeno s hidrolizo soli (kemična reakcija, ki vključuje topno sol in vodo).
Kot konstanta katerega koli drugega ravnovesja je izraz konstanta hidrolize je sestavljen iz produkta koncentracije izdelka, deljenega z zmnožkom koncentracij reagenta, kot sledi:
Kh = [izdelki]
[reagenti]
Delo s konstanto hidrolize vključuje poznavanje treh pomembnih pojavov:
- Disociacija soli;
- Ionizacija vode;
- Hidroliza soli.
Disociacija soli
Ko vodo dodamo topno sol, ta disociira in sprosti kation, ki ni hidronij (H +) in anion, ki ni hidroksil (OH-).

Da vas spomnimo, kdaj je sol v vodi topna ali ne, Klikni tukaj in preuči tabelo topnosti soli.
ionizacija vode
Voda je snov, ki je naravno izpostavljena pojavu samoionizacije, to pomeni, da tvori hidronijev kation in hidroksilni anion.
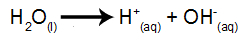
enačba ionizacije vode
hidroliza soli
Kot topna sol sprošča ione v vodo in voda jo ionizira, pri čemer nastaja ioni na sredini lahko pride do reakcije (hidrolize) med solnimi ioni in vodnimi ioni. Ko pride do te reakcije, so možne interakcije:
- Kation soli z anionom vode (tvorba baze);
- Anion soli s kationom vode (tvorba soli);
Zgornje interakcije se bodo pojavile le, če je osnova ali kislina, ki nastane, šibka.
Glej primer hidrolize soli:
→ Hidroliza amonijevega hipoklorita (NH4ClO)
Ko se vodi doda amonijev hipoklorit, se ta raztopi in disociira, pri čemer se sprostijo amonijevi kation ioni (NH4 +) in hipokloritni anion (ClO-):

Enačba, ki prikazuje ione, ki se sproščajo pri disociaciji amonijevega hipoklorita
Ker voda pri ionizaciji proizvaja H + in OH-, imamo v raztopini dva kationa in dva aniona, ki lahko reagirata. Kation NH4 + reagira samo z OH-anionom, ker tvori šibko bazo (NH4OH). ClO-anion reagira samo s kationom H +, ker tvori šibko kislino (HClO).

Enačba ravnotežja hidrolize amonijevega hipoklorita
Konstrukcija izraza hidrolizne konstante
Konstrukcija hidrolizne konstante soli je odvisna izključno od enačbe hidrolize za to sol. Hidroliza amonijevega hipoklorit, na primer, obdelana v prejšnji točki, je ustvarila naslednjo enačbo:

Enačba ravnotežja hidrolize amonijevega hipoklorita
Kako zgraditi izraz konstanta hidrolize upošteva izdelke in reagente, bi bil izraz konstante:
Kh = [HClO]. [NH4OH]
[ClO -]. [NH4 +]
OPOMBA: Voda v enačbi ne sodeluje, ker je tekoči reagent in tudi zato, ker je temeljno sredstvo za pojav hidrolize, to je konstantna.
Jaz, Diogo Lopes Dias
Vir: Brazilska šola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-constante-hidrolise.htm


