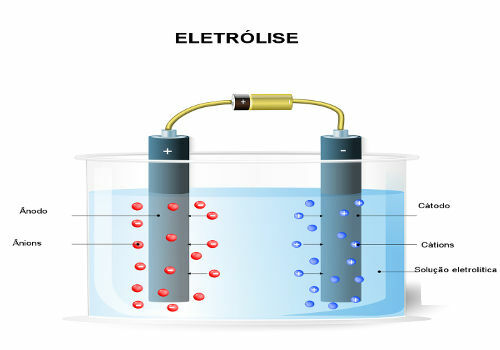
Celice ali elektrokemične celice in baterije so naprave, v katerih se kemična energija spontano pretvori v električno energijo.Celica je sestavljena iz samo dveh elektrod in elektrolita, medtem ko je baterija niz baterij zaporedno ali vzporedno.
Ob primarne baterije so naprave, ki jih ni mogoče polniti, ker ko preneha reakcija oksidacijske-redukcije, ki poteka znotraj njih, jih je treba zavreči.
Za vsako opremo je navedena vrsta akumulatorja, med trenutno uporabljenimi primarnimi baterijami pa so glavne: Leclanchéjeve suhe celice (običajne baterije ali kislinske celice), alkalne baterije in litij / manganove dioksidne baterije.
Oglejte si, v čem se razlikujejo in za katero opremo so primerni:
- Suhe celice Leclanché:
Te kupe v bistvu tvorijo cinkova ovojnica, ločena s poroznim papirjem in osrednjo grafitno palico, obdano z manganovim dioksidom (MnO2), oglje v prahu (C) in mokra pasta, ki vsebuje amonijev klorid (NH4Cl), cinkov klorid (ZnCl2) in vodo (H2O).
O cink deluje kot anoda, izgubljanje elektronov; to je grafit deluje kot katoda, ki prevaja elektrone v manganov dioksid:
Anodna polovična reakcija: Zn (s) → Zn2+(tukaj) + 2 in-
Pol reakcija katode: 2 MnO2 (aq) + 2 NH41+(tukaj) + 2e- → 1 Mn2O3(s) + 2NH3 (g) + 1 ura2O(1)
Globalna reakcija: Zn (s) + 2 MnO2 (aq) + 2 NH41+(tukaj) → Zn2+(tukaj) + 1 Mn2O3 (s) + 2NH3 (g)
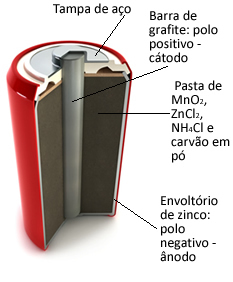
Ta vrsta baterij je primerna za opremo, ki zahteva svetlobo in neprekinjeno praznjenje, kot so daljinski upravljalnik, stenska ura, prenosni radio in igrače.
Več podrobnosti o izvoru, delovanju, trajnosti, ddp, nevarnostih in previdnostnih ukrepih, ki jih je treba upoštevati s temi baterijami, najdete v besedilu “Leclanché Dry Stack”.
Ne ustavi se zdaj... Po oglaševanju je še več;)
- Alkalne baterije:
Njegovo delovanje je zelo podobno delovanju suhih celic Leclanchéja, vendar je edina razlika v tem, da namesto klorida amonija (ki je kisla sol), se doda močna baza, predvsem natrijev hidroksid (NaOH) ali kalijev hidroksid (KOH).
Anodna polovična reakcija: Zn + 2 OH → ZnO + H2O + 2e-
Pol reakcija katode: 2 MnO2 + H2O + 2e-→ Mn2O3 + 2 OH
Celotna reakcija: Zn +2 MnO2→ ZnO + Mn 2O3

Alkalne baterije so bolj ugodne od kislih v smislu, da imajo večjo trajnost v letu običajno zagotavljajo 50–100% več energije kot običajna baterija enake velikosti, poleg tega pa obstaja tudi manjša nevarnost pušča.
Namenjeni so predvsem napravam, ki zahtevajo hitrejše in intenzivnejše prenose, kot so radijski sprejemniki, prenosni CD / DVD in MP3 predvajalniki, svetilke, digitalni fotoaparati itd.
Preberite tudi besedilo Alkalne baterije.
- Litijeve / manganove dioksidne baterije:
Te baterije so lahke in ustvarjajo veliko napetost (približno 3,4 V), zato se pogosto uporabljajo v majhni opremi, kot so ure in kalkulatorji. Za razliko od prejšnjih primerov je njegova oblika kovanec, kot je prikazano na naslednji sliki:

Anoda je litij, katoda manganov dioksid, elektrolit pa fiziološka raztopina:
Anodna polovična reakcija: preberite →preberite+ + in−
Pol reakcija katode: MnO2 + preberi+ + in−→MnO2(li)
Splošna reakcija: Li + MnO2 → MnO2(li)
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Najpogostejše vrste celic in primarne baterije"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/tipos-pilhas-baterias-primarias-mais-comuns.htm. Dostop 27. junija 2021.