Obstaja veja znanosti, ki preučuje hitrost kemijskih reakcij in dejavnike, ki nanjo vplivajo, in se imenuje kemijska kinetika. Kemične reakcije lahko opredelimo kot skupek pojavov, pri katerih dve ali več snovi medsebojno reagirajo in povzročijo različne spojine. Kemijska enačba je grafični prikaz kemijske reakcije, kjer se v prvem članu pojavijo reaktanti, v drugem pa produkti.
A + B  C + D
C + D
Reagenti Izdelki
Znanje in proučevanje reakcij je poleg tega, da je zelo pomembno v industrijskem smislu, povezano tudi z našim vsakdanjim življenjem.
Hitrost reakcije je, kako hitro se porabijo reaktanti ali kako hitro nastanejo proizvodi. Gorenje sveče in nastajanje rje sta primera počasnih reakcij. Pri dinamitu je razgradnja nitroglicerina hitra reakcija.
Hitrosti kemičnih reakcij se določajo z empiričnimi zakoni, imenovanimi zakoni hitrost, izračunana na podlagi vpliva koncentracije reaktantov in produktov na hitrost reakcija.
Kemijske reakcije se pojavljajo pri različnih hitrostih in jih je mogoče spremeniti, ker poleg koncentracije reaktantov in produktov, so hitrosti reakcij odvisne tudi od drugih dejavnikov kot:
Koncentracija reagenta: višja kot je koncentracija reaktantov, hitrejša bo reakcija. Da bi prišlo do reakcije med dvema ali več snovmi, mora molekula trčiti, tako da pride do prekinitve vezi in posledičnega nastanka novih. Število trkov bo odvisno od koncentracije A in B. Oglejte si sliko:
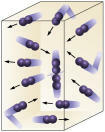
Molekule trčijo pogosteje, če
povečujemo število reagirajočih molekul.
Lahko je videti, da bo zaradi večje koncentracije prišlo do povečanja trkov med molekulami.
kontaktna površina: povečanje kontaktne površine poveča reakcijsko hitrost. Primer je, ko raztopimo zdrobljeno tableto sonrisal in se ta hitreje raztopi kot če bi bila cela, se to zgodi, ker povečujemo kontaktno površino, ki reagira z Voda.
Pritisk: ko povečate tlak v plinastem sistemu, se reakcijska hitrost poveča.
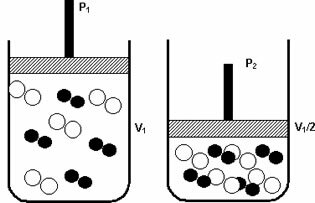
Povišanje tlaka s P1 na P2 je zmanjšalo prostornino z V1 na V1 / 2 in pospešilo reakcijo zaradi približevanja molekul.
Zgornja slika ponazarja, saj bo ob zmanjšanju prostornine v drugi posodi prišlo do povečanja pritisk, ki povečuje trke molekul in posledično povečuje hitrost reakcija.
Temperatura: ko je temperatura sistema povišana, se poveča tudi hitrost reakcije. Povišanje temperature pomeni povečanje kinetične energije molekul. Vsakodnevno lahko opazujemo ta dejavnik med kuhanjem in povečujemo plamen štedilnika, tako da hrana hitreje doseže stopnjo kuhanja.
Katalizatorji: Katalizatorji so snovi, ki pospešijo mehanizem, ne da bi se trajno spremenile, to pomeni, da se med reakcijo ne porabijo. Katalizatorji omogočajo, da reakcija preide na drugo pot, ki zahteva manj aktivacijske energije, zaradi česar reakcija poteka hitreje. Pomembno je vedeti, da katalizator pospeši reakcijo, vendar ne poveča donosa, torej proizvede enako količino produkta, vendar v krajšem časovnem obdobju.
Avtor Líria Alves
Diplomiral iz kemije
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/cinetica-quimica.htm

