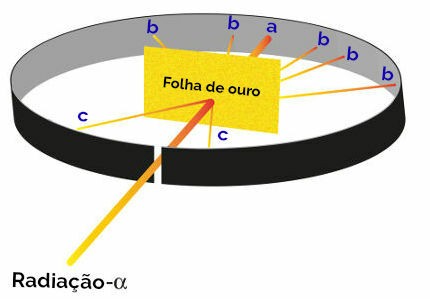
Atom je ime oblikovalca snovi (vsega, kar zaseda prostor in ima maso). To ime so predlagali grški filozofi Demokrit in Levkip. Kemični elementi, molekule, snovi organske ali anorganske materiale pa tvorijo atomi.
V svoji konstituciji ima atom delce (protone, nevtrone in elektrone), ki niso najmanjši del snovi. Kljub temu, vaša vizualizacija ni mogoča. Kar je znano o atomu, je povezano z znanstveno dokazanimi fizikalnimi, kemijskimi in matematičnimi vidiki.
Razvoj znanja o atomu je povzročil razvoj in izboljšanje več tehnologij.
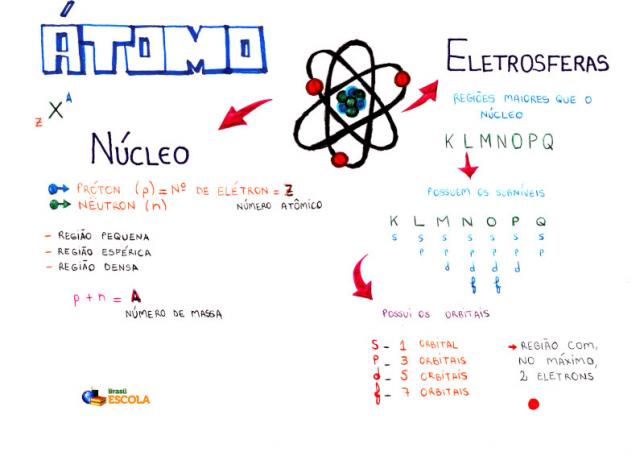
Osnovna sestava atoma
Jedro: gostejše območje atoma in vsebuje protone in nevtrone;
Ravni energije: regije, ki obkrožajo jedro in v katerih se nahajajo podnivoji, orbitale in elektroni. Obstaja sedem nivojev energije, ki jih predstavljajo črke K, L, M, N, O, P in Q;
Podravni energije: so regije, v katerih so orbitale. Prisotni so na vseh ravneh in so predstavljeni s črkami (s, p, d f). Njegova količina je odvisna od posamezne ravni: K (ima s podnivoji), L (ima s in p podnivoji), M (ima s, p in d podnivoji), N (ima podnivoje s, p, d in f), O (ima podnivoje s, p, d in f), P (ima podnivoje s, p in d) in Q (ima podnivoje s in P);
Atomske orbitale: regije, ki bodo najverjetneje našle elektron. Vsak podnivo ima različno število orbital: s (ena orbitala), p (tri orbitale), d (pet orbitalov) in f (sedem orbital);
protoni: pozitivni delci (predstavljeni s p);
elektroni: negativni delci, ki imajo tudi valovno vedenje (predstavljeno z e);
nevtroni: nenaelektreni delci, ki zmanjšajo odbojnost med protoni v jedru (predstavljeni z n).
Zemljevid uma: Atom
* Če želite prenesti miselni zemljevid v PDF, Klikni tukaj!
predstavitev atoma
Atom je najpreprosteje predstavljen z uporabo okrajšave kemičnega elementa, ki ga tvori. Kratica Se na primer predstavlja vse atome, ki tvorijo kemični element selen.
Kratica, ki predstavlja atom, lahko še vedno daje dva pomembna podatka: atomsko številko (predstavljeno s črko Z in vedno na levi strani dnu kratice atoma) in masno številko (predstavljeno s črko A, ki jo lahko namestite na levo ali desno stran na vrhu kratice atom).
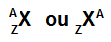
Kratica atoma z masnim številom in atomskim številom
atomsko število (Z): označuje število protonov, prisotnih v jedru atoma, in število elektronov (e), prisotnih v nivojih energije.
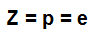
Formula, ki označuje reprezentativnost atomskega števila
-
Masno število (A): označuje maso, prisotno v jedru atoma, ki izhaja iz vsote števila protonov (p) in števila nevtronov (n).
Ne ustavi se zdaj... Po oglaševanju je še več;)

Formula, ki označuje reprezentativnost masnega števila
Atomske podobnosti
Atome istega kemičnega elementa ali različnih kemičnih elementov lahko primerjamo glede na število protonov, elektronov, nevtronov in maso, pri čemer jih razvrstimo na naslednji način:
a) Izotopi
So atomi, ki imajo:
isto atomsko število;
enako število protonov;
različno masno število;
različno število nevtronov;
Primer:
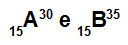
Atoma A in B sta izotop
Atoma A in B sta izotopa, ker:
Atom A ima 15 protonov, atomsko število je enako 15, 15 elektronov, 15 nevtronov in masno število je enako 30.
Atom B ima 15 protonov, atomsko število je enako 15, 15 elektronov, 20 nevtronov in masno število je enako 35.
b) izobare
So atomi, ki imajo:
različne atomske številke;
različno število protonov;
različno število elektronov;
enaka masna števila;
različno število nevtronov.
Primer:
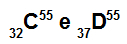
Atoma C in D sta izobarja
Atoma C in D sta izobarna, ker:
Atom C ima 32 protonov, atomsko število je enako 32, 32 elektroni, 23 nevtroni in masno število je enako 55.
Atom D ima 37 protonov, atomsko število je enako 37, 37 elektronov, 18 nevtronov in masno število je enako 55.
c) Izotoni
So atomi, ki imajo:
različne atomske številke;
različno število protonov;
različno število elektronov;
različna masna števila;
enako število nevtronov.
Primer:
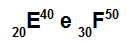
Atoma E in F sta izotopa
Atoma E in F sta izotopa, ker:
Atom E ima 20 protonov, atomsko število je enako 20, 20 elektronov, 20 nevtronov in masno število je enako 40.
Atom F ima 30 protonov, atomsko število je enako 30, 30 elektronov, 20 nevtronov in masno število je enako 50.
d) Izoelektronika
So atomi, ki imajo:
enako število elektronov.
OPOMBA: izoelektronski atomi imajo lahko tudi enako masno število (izobare), enako število nevtronov (izotoni) ali enako število protonov (izotopi).
Primer:
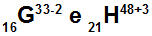
Atoma G in H sta izoelektronska
Atoma G in H sta izoelektronska, ker:
Atom G ima 16 protonov, atomsko število je enako 16, 18 elektronov (znak -2 pomeni, da ima dva elektrona več kot število protonov), 17 nevtronov in masno število enako 33.
Atom H ima 21 protonov, atomsko število je enako 21, 18 elektronov (znak +3 pomeni, da ima tri elektrone manj kot število protonov), 27 nevtronov in masno število je enako 48.
Jaz, Diogo Lopes Dias
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
DNI, Diogo Lopes. "Kaj je atom?"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-atomo.htm. Dostop 27. junija 2021.
Kemija
Atomi in konstrukcija vesolja, atomska teorija, da je vse narejeno, snov je sestavljena iz atomov, teorija štirih elementov, starodavni alkimisti, atomska teorija, temeljni delci.
Kemija

Niels Bohr, Bohrov atom, atomska fizika, stabilni atom, atomski model, planetarni sistem, plasti elektrosfere, energijske ravni, elektronske lupine, elektronska energija, Rutherfordov atomski model, atom vzbujenega stanja.