Do izobarne transformacije pride, ko je plin pod konstantnim tlakom. Če je na primer transformacija izvedena v odprtem okolju, bo izobarna, saj bo tlak atmosferski tlak, ki se ne bo spremenil.
V tem primeru se temperatura in prostornina spreminjata. Dva vodilna znanstvenika sta preučevala, kako se pojavlja ta sprememba v izobarnih transformacijah. Prvi, ki je povezal prostornino in temperaturo plinov, je bil Jacques Charles (1746-1823), leta 1787, nato pa je leta 1802 Joseph Gay-Lussac (1778-1850) to razmerje kvantificiral.
Tako se je pojavil zakon, ki pojasnjuje izobarne transformacije plinov, ki so postali znani kot Charles / Gay-Lussacov zakon. Navedeno je naslednje:
"V sistemu s konstantnim tlakom je prostornina fiksne mase plina neposredno sorazmerna s temperaturo."

To pomeni, da če podvojimo temperaturo, se bo podvojila tudi prostornina plina. Če pa znižamo temperaturo, se bo v enakem razmerju zmanjšala tudi količina plina.
To je razvidno iz zelo preprostega poskusa. Če balon postavimo v grlo steklenice, bo ujeta fiksna masa zraka. Če to steklenico pomočimo v skledo z ledeno vodo, se bo balon izpuhnil. Če ga damo v skledo z vročo vodo, se bo balon napolnil.
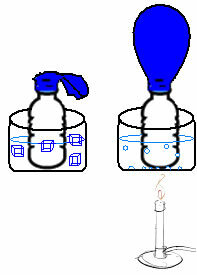
To je zato, ker se s povečanjem temperature poveča kinetična energija molekul plina in poveča tudi hitrost njihovega gibanja. Tako se plin širi, povečuje prostornino, ki jo zasede, in balon se napihne. Nasprotno se zgodi, ko znižamo temperaturo in jo postavimo v hladno vodo.
Ne ustavi se zdaj... Po oglaševanju je še več;)
To razmerje med temperaturo in prostornino pri izobarnih transformacijah dobimo z naslednjim razmerjem:
V = k
T
"k" je konstanta, kot je razvidno iz naslednjega grafa:
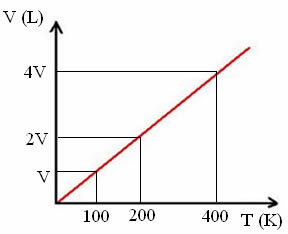
Upoštevajte, da razmerje V / T vedno daje konstanto:
_V_ =_2V_ = _4V_
100 200 400
Tako lahko vzpostavimo naslednje razmerje za izobarne transformacije:
Vzačetno = VKončno
Tzačetno TKončno
To pomeni, da kadar pride do kakršne koli spremembe temperature plina pri konstantnem tlaku, lahko s pomočjo tega matematičnega izraza poiščemo njegovo prostornino. Velja tudi nasprotno, saj poznamo prostornino plina in ugotovimo, pri kateri temperaturi je. Glej primer:
"Plinasta masa ima prostornino 800 cm3 pri -23 ° C, pri določenem tlaku. Kakšna je temperatura, zabeležena, ko plinasta masa pri enakem tlaku zavzame prostornino 1,6 L? "
Resolucija:
Podatki:
Vzačetno = 800 cm3
Tzačetno = -23 ºC, če dodamo 273, imamo 250 K (Kelvin)
VKončno = 1,6 L
TKončno = ?
* Najprej moramo pustiti glasnost na isti enoti. Znano je, da 1 dm3 enako 1 litru. kot 1 dm3 je enako 1000 cm3, se zdi, da je 1 liter = 1 000 cm3:
1 L 1000 cm3
x 800 cm3
x = 0,8 L
* Zdaj nadomestimo vrednosti formule in poiščemo končno vrednost temperature:
Vzačetno = VKončno
Tzačetno TKončno
0,8_ = 1,6
250 TKončno
0,8 TKončno = 250. 1,6
TKončno = 400
0,8
TKončno = 500K
* Če se pomaknemo na Celzijevo lestvico, imamo:
T (K) = T (° C) + 273
500 = T (° C) + 273
T (° C) = 500 - 273
T (° C) = 227 ° C
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Izobarska preobrazba"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/transformacao-isobarica.htm. Dostop 27. junija 2021.
Kaj so plini, kakšne so lastnosti plinov, molekularne spojine, stisljivost, fiksna prostornina, kinetična energija srednja, absolutna temperatura plina, idealni plin, realni plini, popolni plin, spremenljivke stanja plina, prostornina plina, letni časi
Kemija

Zakoni Gay-Lussac, Proustov zakon, Kemijske reakcije, Konstanten delež, Mase snovi, Čista snov, Analiza kvalitativni in kvantitativni, zakon popolnih plinov, zakon stalnih proporcij, zakon določenih razmerij, zakon volumetrična.