Eden največjih izzivov za vse, ki se učijo kemije, se imenuje elektronska distribucija. Kar bomo predstavili v tem kontekstu, vam lahko močno olajša študije, povezane z elektronsko konfiguracijo, ki jo je predlagal znanstvenik Linus Pauling.
V tabeli je podano največje število elektronov, ki se prilega posamezni plasti ali nivoju energije:
Plast nivoja energije Največje število elektronov
1. K 2
2. L 8
3. M 18
4. N 32
5 ° O 32
6. P 18
7. Q 8
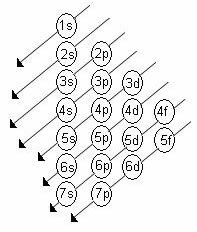
Naraščajoči red energije podnivojev je vrstni red v zaporedju diagonal. Diagram Linusa Paulinga je prikazan spodaj:
Osnovna pravila:
1. Atomsko število (Z) elementa v nevtralnem stanju označuje število elektronov, ki jih je treba razporediti. Ta številka je predstavljena v spodnjem levem delu simbola elementa.
2. Z uporabo Paulingovega diagrama začnite porazdeljevati elektrone od zgoraj navzdol, pri čemer upoštevajte naraščajoč vrstni red energije (usmerjen po smeri puščic).
3. Podrazine napolnite z največjo stopnjo elektronov. Če dani podnivo vsebuje samo 6 elektronov, ne presegajte te količine.
4. Preverite število elektronov, tako da jih seštejete v vsako podnivo.
Uresničimo v praksi?
Porazdelite elektrone železovega atoma (Z = 26).
Če je atomsko število 26, to pomeni, da je v običajnem atomu železa 26 elektronov. Z uporabo Paulingovega diagrama bomo imeli:
Ne ustavi se zdaj... Po oglaševanju je še več;)

Avtor Líria Alves
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Pravila elektronske distribucije"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/regras-distribuicao-eletronica.htm. Dostop 27. junija 2021.