aktivni izomeri ali optično aktivni izomeri (IOA) so molekule določene kemične snovi, ki lahko izvajajo polarizacijo in odstopanje načrt za svetloba desno ali levo. Če želite preveriti, ali ima snov aktivne izomere, samo preverite, ali je v strukturni formuli asimetrični ogljik:

Z analizo verige, predstavljene na zgornji sliki, lahko vidimo, da osrednji ogljik ima štiri različne ligande (OH, H, CH3 in Cl), zaradi česar je a ogljik asimetrična, imenovan tudi ogljik kiralno. Torej, kadar ima veriga enega ali več kiralnih ogljikov, bodo aktivni izomeri.
Ti vrste aktivnih izomerov(IOA) so:
Desničar: Aktivni optični izomer, ki upogne polarizirano svetlobo v desno;
Levogiro: Aktivni optični izomer, ki upogne polarizirano svetlobo v levo.
Opazovanje: Prisotnost asimetričnega ogljika v strukturni formuli kaže, da mora imeti snov levorotacijski izomer in desno vrtljivi izomer. Na nas ni odvisno, na kakšen način je bila svetloba odklonjena, saj prisotnost kiralnega ogljika to že dokazuje. Vedno je polovica obstoječih molekul levičarka, druga polovica pa levičarka.
Levi in desni molekuli katere koli organske snovi imajo vedno enake fizikalne lastnosti (točka tališče, vrelišče, gostota, topnost itd.), vendar so prisotne kemične aktivnosti (vedenje v organizmu) veliko različnih. Primer je adrenalin. V telesu deluje le molekula adrenalina levogira, dekstrogira pa ne.
Oglejte si zdaj strukturno formulo snovi butan-2-ol, da preverite, ali ima aktivne izomere ali ne:
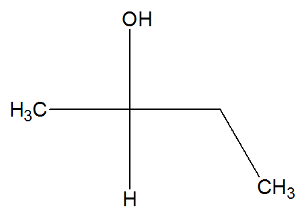
V strukturi butan-2-ola lahko opazimo ogljik 2 štiri različna veziva (OH, H, CH3, CH2-CH3), torej je kiralni ogljik in predstavlja desno vrtljivi aktivni izomer in drug levorotacijski aktivni izomer.
Izračun aktivnih izomerov (IOA)
Nizozemski kemik Jacobus Henricus van't Hoff razvil formulo, ki omogoča izračun, koliko aktivnih izomerov (IOA) lahko vsebuje določena snov. Poglej:
IOA: 2št
n: je število kiralnih ogljikov v strukturni formuli snovi.
Upoštevajte dva primera uporabe formule Vant't Hoff:
5-dikloro-2,3-dihidroksi-heksandiojska kislina

V strukturni formuli spojine so trije kiralni ogljiki ali nesimetrična, zato:
IOA = 2št
IOA = 23
IOA = 8
2,3,4,5-tetrahidroksiheksanal

V strukturni formuli spojine so štirje kiralni ogljiki (rdeče puščice) ali asimetrično, zato:
IOA = 2št
IOA = 24
IOA = 16
Opazovanje: Obstaja možnost, da ima strukturna formula dva asimetrična ogljika, ki imata popolnoma enaka liganda. Če se to zgodi, pri izračunih upoštevamo samo 1 za vrednost n, ne pa 2. Glej primer:
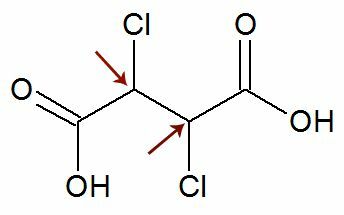
Všeč mi je dva kiralna ogljika so enako, upoštevamo samo enega ogljik pri izračunu:
IOA = 2št
IOA = 21
IOA = 2
Jaz, Diogo Lopes Dias
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/isomeros-ativos.htm