Reakcije sulfoniranja v alkanih so reakcije organske substitucije, izvedeno z namenom proizvodnje sulfonske kisline (organske spojine, ki imajo SO skupino3H, pritrjen na atom ogljika ali na ogljikovo verigo) in vodo (H2O).
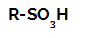
Strukturna formula sulfonske kisline
Za izvedbo sulfonacijske reakcije na alkani, moramo mešati alkan (spojina, ki jo tvori ogljikova veriga, nasičena samo z atomi ogljika in vodika) in žveplova kislina (H2SAMO4) koncentriran, izpostavljen segrevanju (∆).
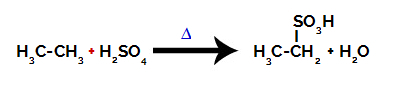
Kemijska enačba, ki predstavlja sulfonacijo dvoogljičnega alkana
Načela reakcije sulfoniranja v alkanih
Kot naprimer reakcija sulfoniranja alkana gre za substitucijsko reakcijo, v njej imamo izmenjavo med manjšimi komponentami elektronegativnost reaktantov, to je med alkanom in žveplovo kislino. Alkan ima vodikov in žveplovo kislino sulfonsko skupino.
Spodaj imamo korak za korakom mehanizem a sulfonacijska reakcija v alkanih. Kot primer bomo uporabili najpreprostejši alkan, metan (CH4):
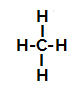
Strukturna formula metana
1. korak: Prekinitev vezi med hidroksilom (OH) in žveplom (S) v žveplovi kislini.
Za vsako hidroksilno skupino, ki je prisotna v žveplovi kislini, je značilno, da je bolj elektronegativna. Pri segrevanju med reakcijo je težnja, da se vez med hidroksilno skupino in žveplom prekine:
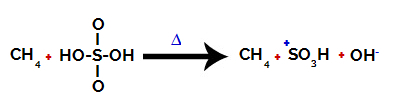
Prekinitev vezi med žveplom in hidroksilom
Vendar do prekinitve vezi vseh hidroksilov ne pride zaradi elektronske prerazporeditve v strukturi. Nato dobimo hidroksidni anion (OH).-) in sulfonski kation.
2. korak: Napad hidroksilne skupine na molekulo alkana.
Nato hidroksi skupina (OH-) izvede napad na alkan, zaradi česar se vez med ogljikom in vodikom (ki je zaradi razlike v elektronegativnosti med njimi bolj krhka) pretrga.
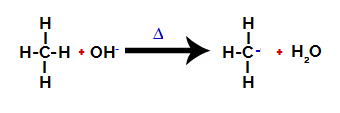
Prekinitev vezi med ogljikom in vodikom v alkanu
Opomba: Prekinitev vezi med ogljikom in vodikom se bo najpogosteje zgodila na ogljiku z nižjo elektronsko gostoto ali nabojem. Manj vodikovih atomov ogljika ali več skupin, povezanih z njim, nižja je njegova elektronska gostota. Torej imamo:
Terciarni ogljik
Po prekinitvi vezi alkan postane ogljik s pomanjkanjem elektronov (karbokacija). Hidroksidna skupina (OH)-) sodeluje s sproščenim vodikom in tvori molekulo vode.
3. korak: Napad tvorjenega radikala na sulfonsko skupino.
Končno na preostalo alkan napade sulfonsko skupino, ki tvori sulfonsko kislino.
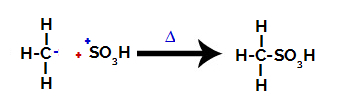
Strukture, ki medsebojno delujejo in tvorijo sulfonsko kislino
Primeri enačb, ki predstavljajo sulfonacijske reakcije v alkanih
1. primer: Sulfoniranje propana.
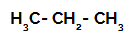
Strukturna formula propana
Propan ima dva primarna ogljika in en sekundarni ogljik, ki imata različna naboja, ker sta vezana na različne količine vodika. Ker je ogljik bolj elektronegativen kot vodik, imajo ti ogljiki drugačno gostoto elektronov.
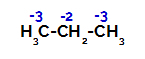
Porazdelitev nabojev na vsak ogljikov atom propana
Na primarnih ogljikih je naboj -3 (ker je vezan na tri vodike), na sekundarnem ogljiku pa je naboj -2 (ker je vezan na dva vodika). Tako bo prišlo do prekinitve vezi med ogljikom in vodikom, včasih pri ogljiku 1 (ene molekule), včasih pri ogljiku 2 (druge molekule).
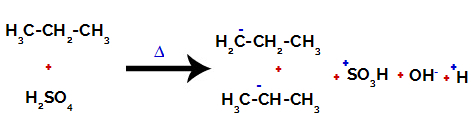
Prekinitev vezi med ogljikom in vodikom na različnih ogljikih
Po prelomih med vezmi, tako v žveplovi kislini kot v alkanu, nastane proizvodi z nadomestitvijo vodika na ogljiku 1 s sulfonsko skupino, enako pa na ogljiku 2.
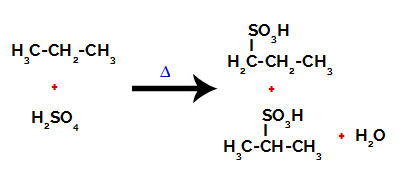
Proizvodi, nastali iz sulfonacije propana
2. primer: Sulfoniranje 2-metil-butana.

Strukturna formula 2-metil-butana
2-metil-butan ima tri primarne ogljike, sekundarni in terciarni ogljik različne naboje in posledično različne elektronske gostote, kot je razvidno iz naslednje zgradbe:
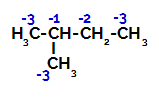
Porazdelitev elektronskih nabojev v 2-metil-butanu
Zato obstaja v 2-metil-butanu več možnosti za prekinitev vezi med ogljikom in vodikom, ki se lahko pojavi na ogljiku 1 (molekule), ogljiku 2 (druge molekule), ogljiku 3 ali ogljiku 4. Vendar je treba omeniti, da so motnje pri ogljikovem številu 2 pogostejše.
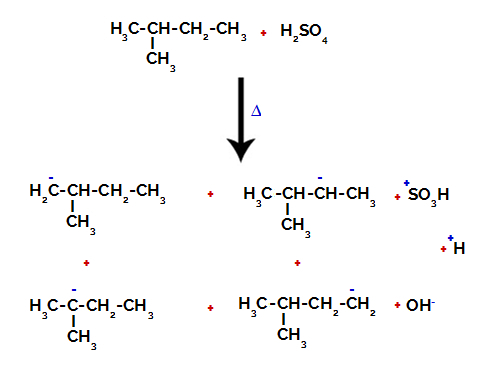
Prekinitev vezi med ogljikom in vodikom na različnih ogljikih
Po prelomu vezi med žveplovo kislino in alkanom nastane proizvodi z nadomestitvijo vodika na ogljiku 1 s sulfonsko skupino, enako pa se zgodi na ogljik 2.

Proizvodi, dobljeni iz sulfonacije 2-metil-butana
Jaz, Diogo Lopes Dias
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/reacoes-sulfonacao-alcanos.htm


