Ogljikov atom velja za posebnega zaradi svoje sposobnosti, da tvori vezi z drugimi atomi in ustvarja dolge ogljikove verige. Vse je posledica tetravalence ogljika, lahko se združi in tvori štiri vezi, sodelujoči atomi pa so lahko ogljik ali drugi elementi. Slednjim, kadar so prisotni v ogljikovi verigi, pravimo heteroatomi.
Najpogostejši heteroatomi so: dušik (N), kisik, žveplo (S) in fosfor (P).
Primer:
Atom kisika, ki je prisoten v zgornji verigi, je heteroatom, saj je med ogljiki.
A pozor! Ne mešajte razvejanosti s heteroatomskim ogljikom, glejte:
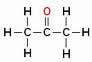
Atom kisika (v rdeči barvi) se ne nahaja med ogljiki, temveč nad njimi in tvori vejo, zato ga ni mogoče šteti za heteroatom.
Razvrstitev atomov v ogljikovi verigi:
V verigi je vsak ogljik razvrščen glede na število drugih atomov ogljika, ki so mu pritrjeni.
primarni ogljik: Neposredno pritrjen samo na 1 drug ogljik.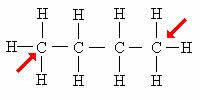
Puščica označuje primarne ogljike. Ker se nahajajo na koncih ogljikove verige, se ti atomi vežejo le na 1 ogljik.
sekundarni ogljik: Neposredno povezan z dvema ogljikoma.

Označena ogljika se nahajajo med dvema ogljikoma.
terciarni ogljik: Neposredno povezan s 3 drugimi ogljiki.
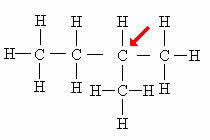
Upoštevajte, da je prisotnost podružnice (CH3), pritrjen na navedeni atom, povzroči, da prejme klasifikacijo terciarnega ogljika.
Kvartarni ogljik: Neposredno povezan s 4 drugimi ogljiki.
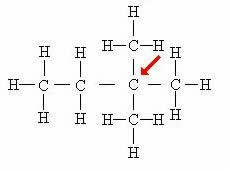
V tem primeru štirje atomi, pritrjeni na osrednji ogljik (označen s puščico), tvorijo nekakšen "kvadrat", kar dodatno dokazuje prisotnost kvartarnega ogljika.
Avtor Líria Alves
Diplomiral iz kemije
Brazilska šolska ekipa
Poglej več!
Klasifikacija ogljikovih verig: vrste vezi
Lastnosti organskih spojin
Organska kemija - Kemija - Brazilska šola
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/capacidade-compostos-organicos-formar-cadeias.htm