V izotermični preobrazbi se nihanje prostornine in tlaka določenega plina, vendar stalna temperatura; od tod izvor izotermičnega imena (grško: izo = enako; termo = toplota).
Znanstvenika Boyle in Mariotte sta ločeno izvedla podobne poskuse in dobljeni rezultat je bil: s povečanjem tlaka se količina plina zmanjša.
Samo pomislite na primer na bat brizge. Če na ta bat izvajamo zunanji pritisk, torej če povečamo tlak, se bo količina zraka, zasedenega v brizgi, zmanjšala in obratno.
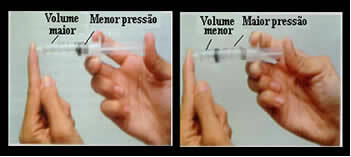
Prostornina in tlak sta obratno sorazmerna: v levem polju je tlak majhen, prostornina zraka pa velika. Na desni strani se ob pritisku na bat brizge glasnost zmanjša.
To ni osamljen primer, ampak nekaj, kar se ponavlja s splošno pravilnostjo za pline. Zato je bilo to dejstvo navedeno v obliki zakona, ki ga lahko opišemo na naslednji način:
| Boyleov zakon ali Boyle-Mariottov zakon: Pri konstantni temperaturi je prostornina, ki jo zaseda fiksna masa plina, obratno sorazmerna njegovemu tlaku. |
To pomeni, da če podvojimo tlak plina, se njegova prostornina prepolovi in tako naprej. Kadar sta dve takšni količini obratno sorazmerni, je njihov proizvod konstanta; tako lahko matematično to razmerje predstavimo na naslednji način:
| P.V = k |
Kjer je k = konstanta.
Če imamo torej v prvem primeru vrednost tlaka določenega plina kot P1 in njegovo prostornino kot V1, potem moramo:
| P1. V1 = k |
Če ta tlak povečamo na P2, se tudi njegova prostornina spremeni v V2 in spet bomo morali:
| P2 . V2 = k |
Tako pridemo do zaključka:
| P1. V1 = P2. V2 |
Ta stalnost je razvidna iz primerov v spodnji tabeli tlakov in prostornin plina s fiksno maso:
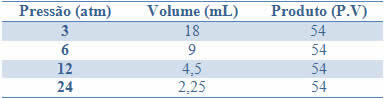
Z grafom teh vrednosti bomo videli oblikovanje krivulje.
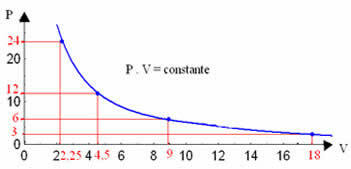
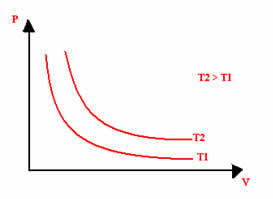
Grafični prikaz izotermične transformacije bo vedno hiperbola, ne glede na vrednosti tlaka in prostornine ter temperature, pri kateri je bil izveden poskus. Ta hiperbola se imenuje izoterma; tako, kot je razvidno iz spodnjega grafa, različne temperature povzročajo različne izoterme.
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/transformacao-isotermica-ou-lei-boyle.htm

