A elektrosfera je območje atoma, v katerem elektroni Nahajajo se. Natančneje, elektrosfera je sestavljena iz atomskih orbital, določenih z rešitvijo Schrödingerjeve enačbe. Elektrosfera, ki je bila najprej določena z Rutherfordovim modelom, je med veljavnostjo Bohrovega atomskega modela dosegla pomemben napredek.
Elektrosfero lahko razdelimo na plasti (ali energijske ravni), saj imajo elektroni določeno (nekontinuirano) energijo. Pri atomih z dvema ali več elektroni se lupine razdelijo na podlupine (ali podlupine). Elektrosfera je izjemno pomembna za razumevanje lastnosti atoma in razumevanje nastanka kemijskih vezi.
Preberite tudi: Kako je atom razdeljen?
Povzetek o elektrosferi
Elektrosfera je področje atoma, v katerem se nahajajo elektroni.
Sestavljen je iz atomskih orbital, valovnih funkcij, ki so rešitve Schrödingerjevih enačb.
Njegov koncept se je začel z modelom Ernesta Rutherforda.
Elektroni se zadržujejo v elektrosferi zaradi svoje privlačnosti k atomskemu jedru.
Glavni napredek v razumevanju elektrosfere se je zgodil med zasnovo modela Nielsa Bohra.
Sestavljen je iz plasti (ali energijskih ravni), ki so območja določene energije.
Pri atomih z več kot enim elektronom se lupine razdelijo na podlupine (ali podlupine).
Elektrosfera je pomembna za razumevanje številnih lastnosti, kot so atomska podobnost, stabilnost, atomski polmer, ionizacijska energija, elektronska afiniteta, poleg razumevanja nastajanja vezi kemikalije.
Video lekcija o elektrosferi
Kaj je elektrosfera?
Elektrosfera je definirana kot območje atomske strukture, v katerem se nahajajo elektroni. V bolj poglobljenih interpretacijah pravimo, da je sestavljena iz atomskih orbital, valovnih funkcij, ki so rešitve Schrödingerjeve enačbe. Matematični izraz atomske orbitale, ko je na kvadrat, predstavlja gostoto verjetnosti lokacije elektrona na dani točki.
O Koncept elektrosfere se je začel pojavljati z Atomski model Ernesta Rutherforda, ki prikazuje elektrone, ki krožijo okoli gostega, pozitivnega jedra. Kasneje je Niels Bohr prinesel pomembnejše interpretacije elektrosfere z mešanjem konceptov iz kvantne mehanike.
Plasti elektrosfere
Elektroni se zadržujejo v elektrosferi zaradi svoje privlačnosti k atomskemu jedru. Vendar je znano, da te elektroni so v lupinah, katerih energija je dobro definirana. Take plasti lahko imenujemo tudi energijske ravni.
Ta ugotovitev je prišla po spektroskopskih poskusih. Na primer, ko na plin H teče električni tok2 Pri nizkem tlaku svetlobo oddaja H2. V tem stanju nastanejo H ioni+ in elektroni, ki se bodo vrnili k H ionom+ in bodo tvorile vzbujene (energizirane) vrste H+. Za razbremenitev odvečne energije H ioni+ sprostijo energijo v obliki elektromagnetnega sevanja (svetlobe) in se rekombinirajo v plin H2 ponovno.
Morda se spomnite, da ko bela svetloba prehaja skozi prizmo, razpade na neprekinjen spekter (podobno mavrici); vendar se to ne zgodi s svetlobo, ki prihaja iz H2: ko takšno sevanje prehaja skozi prizmo, so v emisijskem spektru H opazne le svetle črte z določeno valovno dolžino2, znane kot spektralne črte.
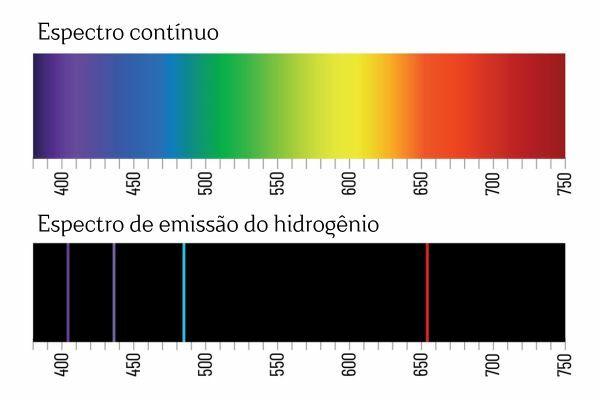
Razlaga emisijskih spektrov elementov (z dobro definiranimi spektralnimi črtami) je, da elektron, v atomu, ne more predstavljati nobene energije, temveč v natančno določenih količinah (tako imenovani energetski paketi). Če elektroni ne bi imeli takšnih energijskih omejitev, bi bil emisijski spekter elementov zvezen, tako kot spekter bele svetlobe, ki gre skozi prizmo.
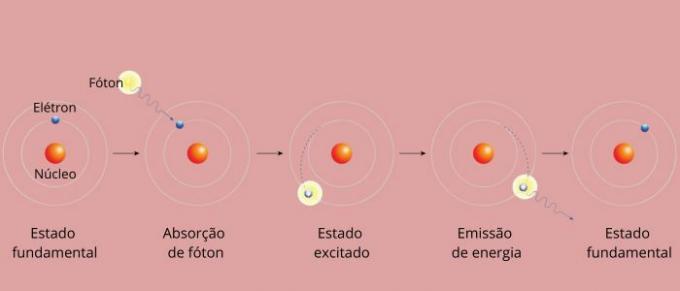
Vsaka spektralna linija elementa je postala znana kot energijska raven. (ali sloj, kot smo bolj vajeni reči). Te črte nastanejo, ko elektron preide z ene dovoljene energijske ravni na drugo, v procesu spremembe energije, znanem kot elektronski prehod.
Pri elektronskem prehodu elektron prehaja z nižje energijske ravni na višjo energijsko raven. Ko se vrne na prvotno raven, oddaja presežek energije preko elektromagnetnega sevanja (svetlobe), ki daje izvora na spektralno črto, katere vrednost oddane energije je sorazmerna z vrednostjo, ki jo določa enačba Rydberg.
Johannes Rydberg je bil švedski spektroskopist, ki je na podlagi dela švicarskega profesorja Johanna Balmerja ustvaril enačbo za opredelitev trenda spektralnih linij. Specifično energijo vsake plasti definiramo z rešitvijo ustrezne Schrödingerjeve enačbe.
Vsaka elektronska plast ima dovoljeno število elektronov. Trenutno je definiranih sedem elektronskih plasti, označenih s črkami od K do Q po abecednem vrstnem redu ali s črko n, kjer je n ≥ 1. Tako je plast K tista, kjer je n = 1 itd. Dovoljeno število elektronov na lupino je prikazano v naslednji tabeli.
Raven energije |
Plast |
Največje število elektronov |
1 |
K |
2 |
2 |
L |
8 |
3 |
M |
18 |
4 |
n |
32 |
5 |
O |
32 |
6 |
p |
18 |
7 |
Q |
8 |
Za hidrogenoidne atome (s samo 1 elektronom, kot je H, He+, Li2+), imajo vse atomske orbitale enako energijo (imenujemo jih degenerirane orbitale); pri atomih z dvema ali več elektroni pa se pojavi zelo pomemben učinek, odboj elektron-elektron. Posledica tega dejstva je, da začnejo imeti orbitale vsake plasti različne energije in zato se plasti začnejo opisovati kot podplasti (ali podravni).
Za trenutne atome je mogoče vsako plast razgraditi na do štiri podravni, ki ga predstavljata črki »s« (iz angleščine, ostro), "p" (iz angleščine, glavni), "d" (iz angleščine, difuzno) in "f" (iz angleščine, temeljni).
Vsaka podnivoj podpira največje število elektronov, opredeljeno z izračuni in poskusi. Podnivo "s" podpira do 2 elektrona; podnivo "p", do 6 elektronov; podnivo "d", do 10 elektronov; in podnivo "f", do 14 elektronov. Sloj K je edini, ki omogoča samo eno orbitalo in ima zato samo eno podnivo.
Raven energije |
Plast |
Podravni |
1 |
K |
1s |
2 |
L |
2s, 2p |
3 |
M |
3s, 3p, 3d |
4 |
n |
4s, 4p, 4d, 4f |
5 |
O |
5s, 5p, 5d, 5f |
6 |
p |
6s, 6p, 6d |
7 |
Q |
7s, 7p |
Delovanje elektrosfere
Elektrosfera vsakega atoma se lahko uporablja za razlago različnih lastnosti in obnašanja atoma.
Lastnosti, kot so atomski radij, ionski radij, ionizacijska energija in elektronska afiniteta, imajo vrednosti, ki so neposredna posledica elektronske konfiguracije elektrosfere, natančneje imenujemo valenčna lupina, ki je pravzaprav najbolj oddaljena zasedena elektronska lupina atoma ali iona.
A podobnost med atomi iz iste skupine v periodnem sistemu je tudi posledica elektronske konfiguracije valenčne lupine. V kemijskih procesih izbiramo atome iz čim bolj iste skupine v periodnem sistemu substituentov, in to je le verjetno, saj imajo ti atomi enako elektronsko konfiguracijo v plasti valence.
Za kemične vezi, ki nastanejo med atomi, da tvorijo ionske in kovalentne spojine (molekule), nastanejo tudi prek interakcij med elektrosferami atomov.
Preberite tudi: Schrödingerjev atomski model — način opisovanja atoma z uporabo kvantne mehanike
Odnos med elektrosfero in atomsko zgradbo
Kot smo že omenili, elektrosfera obsega področje atoma, v katerem so elektroni. Natančneje, elektroni se nahajajo v atomskih orbitalah, katerih energija je določena s kvantnimi izračuni.
Elektrosfera je največje območje atomske strukture, saj je jedro atoma zelo majhno. Če si atom predstavljamo kot nogometni stadion, bi jedro ustrezalo žogi v središču igrišča, preostali del stadiona pa bi bila elektrosfera.
Kljub temu, kar zadeva maso, elektrosfera prispeva malo. Ker je masa elektronov približno 1836-krat manjša od mase protonov in nevtronov, lahko rečemo, da je skoraj vsa masa atoma skoncentrirana v jedru.
Rešene vaje na elektrosferi
Vprašanje 1
(Facisb 2023) V Bohrovem modelu za atom vodika lahko elektron zasede le določene orbite. Nekatere od teh orbit so predstavljene na sliki, kjer se n nanaša na nivoje energije, ki jih ima elektron v vsaki orbiti.
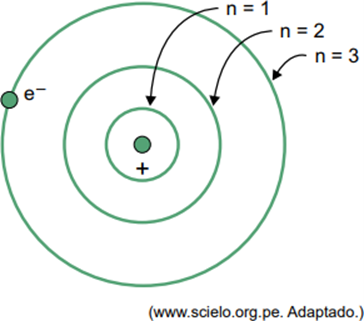
Upoštevajte, da je v atomu vodika elektron v orbiti, kjer je n = 5.
Po Bohrovem modelu bo ta elektron oddajal energijo v obliki elektromagnetnega sevanja šele, ko
(A) narediti prehod v orbito, v kateri je n enako 6.
(B) ostanejo v orbiti, kjer je n = 5.
(C) prehod v katero koli orbito, v kateri je n večji od 5.
(D) prehod v katero koli orbito, v kateri je n manjši od 5.
(E) se izloči iz atoma in ga ionizira.
Odgovor: črka D
Ko je elektron v zunanji lupini, ob vrnitvi v notranjo lupino z nižjo energijo sprosti odvečno energijo v obliki elektromagnetnega sevanja (svetlobe). Zato se bo svetloba pojavila le, ko bo elektron, ki je prisoten v n = 5, naredil prehod v notranjo lupino.
2. vprašanje
(Junej 2019) Pred kratkim je znanstvenikom uspelo proizvesti kovinski vodik s stiskanjem molekularnega vodika pod visokim pritiskom. Kovinske lastnosti tega elementa so enake kot pri drugih elementih v skupini 1 periodične klasifikacijske tabele.
Ta podobnost je povezana z najbolj energijsko podravnijo teh elementov, ki ustreza:
(A) ns1
(B) n.p.2
(C) ne3
(D) nf4
Odgovor: črka A
Vodikov atom ima le en sam elektron, ki se nahaja na prvi ravni, podravni "s" (1s1). Eden od razlogov, zakaj ga najdemo v skupini 1 periodnega sistema, je ta, da imajo vsi drugi kemični elementi v tej skupini atome, katerih valenčna lupina je iste vrste (ns1). Zato je zaradi podobne valenčne plasti lahko vodik nastal v tej kovinski obliki.
Viri:
DO CANTO, E. L.; LEITE, L. L. W.; CANTO, L. W. Kemija – v vsakdanjem življenju. 1. izd. São Paulo: Moderna, 2021.
ATKINS, P.; JONES, L.; LAVERMAN, L. Načela kemije: Spraševanje o življenju in okolju. 7. izd. Porto Alegre: Bookman, 2018.
ATKINS, P.; DE PAULA, J.; KEELER, J. Atkinsova fizikalna kemija. 11 izd. Oxford: Oxford University Press, 2018.


