To lahko opazimo kadarkoli povečamo koncentracijo enega ali vseh reaktantov, ki sodelujejo v kemijski reakciji, se poveča njena hitrost razvoja, to je hitrost reakcije.
Res je tudi obratno. Na primer, trenutno je priporočljivo, da namesto običajnega alkohola uporabljamo alkoholni gel, saj je manjše tveganje, da bi zagorel in se tako izognili nesrečam. Običajni tekoči alkohol je pravzaprav mešanica alkohola in vode, pri čemer alkohol v gelih vsebuje manjšo količino alkohola. Kadar se koncentracija enega od reagentov zgorevanja zmanjša, pri alkoholu reakcija poteka počasneje. Po drugi strani pa je čistejši alkohol, hitrejša je reakcija izgorevanja.

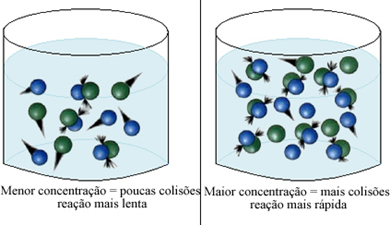
Kot je navedeno v besedilu Pogoji za pojav kemijskih reakcij, eden od pogojev za reakcijo je učinkovito trčenje med delci. Tako povečanje koncentracije reagentov omogoča, da je večja količina delcev ali molekul v istem prostoru. To poveča količino trkov med njimi in poveča verjetnost, da se bodo zgodili učinkoviti trki, ki bodo povzročili reakcijo. Rezultat tega je, da se reakcija pojavi hitreje.
Če si želite to ogledati, pomislite na naslednji primer: če imamo goreče žerjavico in želimo, da se zgorevanje hitreje procesira, ali žerjavico pihamo ali razpihujemo? Zakaj to deluje?
No, eden od reaktantov v tej reakciji izgorevanja je kisik v zraku. Ko se stresamo, zračni tok odstrani pepel, ki nastaja med zgorevanjem, kar olajša stik kisika z žerjavico. Na ta način povečamo stik med reaktanti in pospešimo reakcijo zgorevanja.
Na kratko imamo:

Pri delu s plini je en način za povečanje koncentracije reaktantov znižajte tlak. Ko to storimo, zmanjšamo prostornino in posledično se poveča koncentracija reagenta.

Avtorica Jennifer Fogaça
Diplomiral iz kemije
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/concentracao-dos-reagentes-velocidade-das-reacoes.htm
