THE topnost ali koeficient topnosti, gre za fizikalno lastnost snovi, ki je vedno praktično določena v laboratoriju. Povezan je s kapaciteto, ki jo t.i. topljen, darila, ki jih mora razpustiti drug, topilo.
Glede topnosti lahko topljene snovi razvrstimo na naslednji način:
Topne snovi: tiste, ki se raztopijo v topilu. Natrijev klorid (topljeno sredstvo) je na primer topen v vodi (topilo);
Rahlo topen: tiste, ki se težko raztopijo v topilu. To je primer kalcijevega hidroksida [Ca (OH)2] (topljeno sredstvo) v vodi;
Netopni: tisti se ne raztopijo v topilu. Pesek (topljeno sredstvo) je na primer v vodi netopen.
THE topnost je zelo povezan s pripravo rešitve (homogene mešanice), ker je za pridobitev raztopine bistvenega pomena, da je uporabljena topljena snov topna v topilu.
Dejavniki, ki vplivajo na topnost
Tudi ko je topljena snov v topilu, obstaja nekaj dejavnikov, ki lahko vplivajo na sposobnost topljenja topljene snovi. Ali so:
a) Razmerje med količino topljene snovi in topila
Topilo ima vedno mejno vrednost topljene snovi, ki jo lahko raztopi. Če povečamo količino topila, hkrati pa ohranjamo količino topljene snovi, topilo raztopi vso uporabljeno topljeno snov.
B) Temperatura
Temperatura je edini fizikalni dejavnik, ki lahko spremeni topnost topila glede na določeno topljeno snov. Ta sprememba je odvisna od narave topljene snovi, kot bomo videli spodaj:
endotermna topljena snov: je tista, pri kateri uspemo raztopiti večjo maso, če je topilo pri temperaturi, višji od sobne. Bolj ko je topilo bolj vroče, več topljene snovi se bo raztopilo.
Primer: Ko je voda vroča, je možno raztopiti večjo količino mlete kave.
Eksotermna topljena snov: je tista, pri kateri uspemo raztopiti večjo maso, če je topilo nižje od sobne temperature. Bolj ko je topilo hladnejše, več topljene snovi se bo raztopilo.
Primer: Ko je soda hladna, je možno raztopiti večjo količino ogljikovega dioksida.
Načini določanja topnosti
Ker je topnost lastnost, ki je določena na eksperimentalni način, so bile topnosti materialov na splošno že ocenjene v najrazličnejših topilih. Tako lahko do topnosti topljene snovi v določenem topilu pridemo na naslednji način:
a) Analiza tabele
Pogosto lahko študent pri interpretaciji tabele naleti na topnost. Glej naslednji primer:
Primer: (UEPG - prilagojeno) Spodnja tabela prikazuje topnost Li soli2CO3 v 100 gramih vode.

Tabela prikazuje masne vrednosti v gramih Li2CO3 ki se lahko raztopi v 100 gramih vode, od 0 OC do 50 OÇ. Vidimo lahko, da je voda bolj vroča, manj Li2CO3 raztopi. Zato Li2CO3 je eksotermna topljena snov (bolj se bo raztopila, če je voda hladna).
b) Analiza grafa
Topnost lahko ocenimo z interpretacijo grafa. Če želite to narediti, preprosto določite temperaturo, jo obrnite na krivuljo in nato krivuljo obrnite na os y, ki je masa raztopljene snovi v gramih.
Primer: (UFTM - prilagojeno) Graf prikazuje krivuljo topnosti soli AX2.
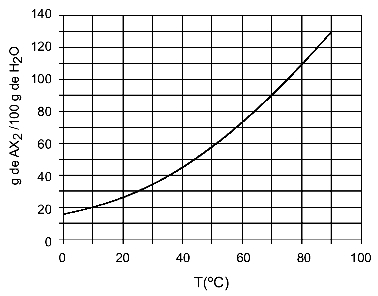
Graf kaže, da je na osi y količina vode (topila) 100 gramov. Za topljeno AX2, bomo določili količino vode pri naslednjih temperaturah:
30OÇ: Ko vklopimo temperaturo 30OC na krivuljo in nato krivuljo na os y, imamo, da lahko pri tej temperaturi 100 gramov vode raztopi približno 35 gramov raztopljene AX2.
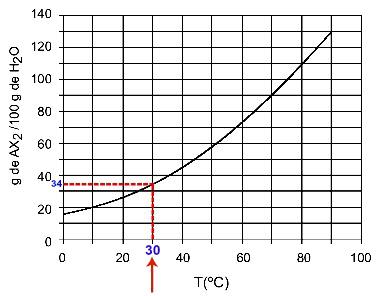
Določanje topnosti AX2 ob 30OÇ
40OÇ: Ko vklopimo temperaturo 40OC na krivuljo in nato krivuljo na os y, imamo, da lahko pri tej temperaturi 100 gramov vode raztopi približno 45 gramov raztopljene AX2.
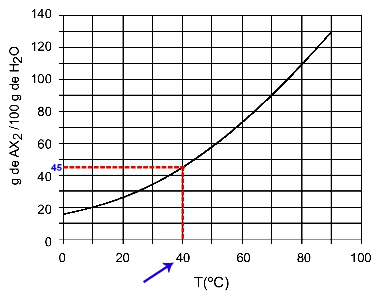
Določanje topnosti AX2 pri 40OÇ
Ker je raztopljena količina topljene snovi z vsakim zvišanjem temperature večja, imamo to AX2 je endotermna topljena snov.
c) besedilna interpretacija
Glej naslednji primer:
Primer: (PUC-MG) Nekatere snovi lahko tvorijo homogene mešanice z drugimi snovmi. Snov, ki je v največji količini, se imenuje topilo, tista, ki je v najmanjši količini, pa topljena snov. Natrijev klorid (NaCl) tvori homogeno raztopino z vodo, v kateri je pri 20 ° C možno topiti 36 g NaCl v 100 g vode.
Besedilo navaja, da če imamo 100 gramov vode (topila), pri temperaturi 20 OC je mogoče raztopiti do 36 gramov NaCl.
Jaz, Diogo Lopes Dias
Vir: Brazilska šola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-solubilidade.htm
