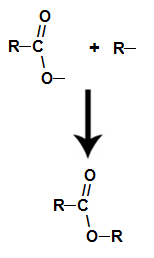
Ti estri so kisikove organske spojine, ki nastanejo s kemično reakcijo med a karboksilna kislina je alkohol. Predstavite funkcionalno skupino (sestavljeno iz dveh atomov kisika in dveh radikali R) predstavljen spodaj:
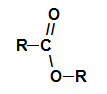
Splošna funkcionalna skupina estra
Strukturno, kaj je značilno za ester gre za prisotnost nekega alkilnega radikala, ki je pritrjen neposredno na atom kisika. V tem primeru je radikal (R), vezan na ogljik - ta pa dvojno vezan na kisik - lahko alkilni radikal ali vodikov atom.
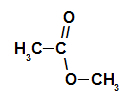
Ogljikova veriga estra
reakcija esterifikacije
gre za kemična reakcija, ki vodi ester in molekulo vode iz interakcije med karboksilno kislino in alkoholom, kot v spodnji enačbi:
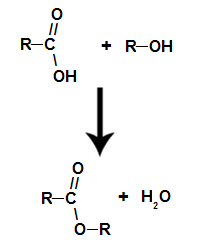
Kemijska enačba, ki predstavlja tvorbo estra
Med esterifikacijo hidroksilna skupina (OH) alkohola sodeluje z vodik (H) ionizirajoče iz hidroksilne kisline in tvori molekula vode.
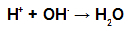
Skupine molekul vode, ki tvorijo esterifikacijo
že ester nastane z vezanjem radikala (R) alkohola s kisikom, ki ostane po hidroksilu kisline po tvorbi vode.
Nastanek molekule estra
Značilnosti estrov
Glavne fizikalne lastnosti, ki jih je predstavil estri:
Imajo sadne in cvetne arome;
nizki estri molska masa so tekoči pri sobni temperaturi, tisti z visoko molsko maso pa trdni;
V primerjavi z alkoholi in karboksilnimi kislinami imajo estri nižja tališča in vrelišča;
V primerjavi z vodo so estri z nižjo molsko maso manj gosti;
Estri z nižjo molsko maso so polarni, z višjo molsko maso pa nepolarni;
V polarnih estrih prevladujejo sile stalni dipol; v nepolarnih prevladujejo sile inducirani dipol;
Estri z nižjo molsko maso so v vodi slabo topni, tisti z večjo maso pa v vodi niso topni.
Pravilo imenovanja Ester
Pred uporabo pravila poimenovanja a ester, nujno je vedeti, da ta spojina nastane z združitvijo dveh delov, od katerih prihaja en karboksilne kisline (v rdeči) in druge alkoholne pijače (v modri barvi), kot je prikazana na sliki a sledite:
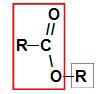
Identifikacija delov, ki izvirajo iz estra
Po podatkih Mednarodne zveze za čisto in uporabno kemijo (IUPAC), uradno pravilo za imenovanje estra je:
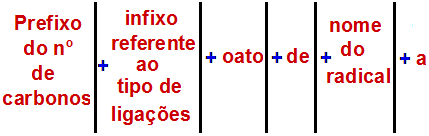
Pravilo imenovanja Ester
Opomba: Predpona in infix vedno ustrezata delu karboksilne kisline, radikal pa alkoholnemu delu.
Spodaj si oglejte nekaj primerov uporabe pravila poimenovanja estrov:
1. primer: esenca maline
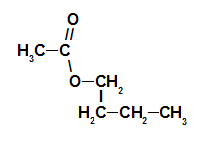
Strukturna formula estra esenc maline
Za poimenovanje tega estra uporabljamo:
Št. PredponaO ogljika: et, saj ima tvorna kislina dva ogljika;
Infix o vrsti povezav: an, saj ima tvorjena kislina le enojne vezi med ogljiki;
dejanje;
v;
Radikalno: butilz zaporedjem štirih ogljikov;
The.
Tako je ime estra, ki ustreza esenci maline, butil etanoat.
2. primer: esenca borovega storža
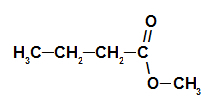
Strukturna formula estra borovega storža
Za oblikovanje imena tega estra uporabljamo:
Št. PredponaO ogljika: ampak, saj ima tvorba kisline štiri ogljike;
Infix o vrsti povezav: an, saj ima tvorjena kislina le enojne vezi med ogljiki;
dejanje;
v;
Radikalno: metil, ker ima alkohol, ki tvori, le en ogljik;
The.
Tako je ime estra, ki ustreza esenci borovega storža metil butanoat.
3. primer: jagodna esenca
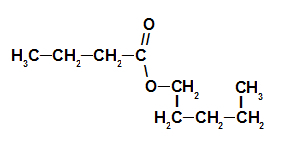
Strukturna formula Strawberry Essence Ester
Za poimenovanje tega estra uporabljamo:
Št. PredponaO ogljika: ampak, saj ima tvorna kislina štiri ogljike;
Infix o vrsti povezav: an, saj ima tvorjena kislina le enojne vezi med ogljiki;
dejanje;
v;
Radikalno: pentil, saj ima alkohol, ki tvori, zaporedoma pet ogljikov;
The.
Tako je ime estra, ki ustreza jagodni esenci, pentil butanoat.
Uporaba estrov
Estri so dobro znani po svoji uporabi kot aroma v predelanih živilih, to je snovi, ki simulirajo značilen okus in aromo naravnih živil, kot je sadje. Poleg tega estri se še vedno uporabljajo v proizvodnji zdravil, kozmetike, parfumov in voskov.
Jaz, Diogo Lopes Dias
Vir: Brazilska šola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-ester.htm

