Reakcije izpodrivanja, imenovano tudi substitucijske reakcijeali še vedno iz preprosta izmenjavaso tisti, ki se pojavijo, ko preprosta snov (ki jo tvori en sam element) reagira s sestavljeno snovjo, ki slednjo "izpodrine" v novo preprosto snov.
Splošno jo lahko opredelimo na naslednji način:
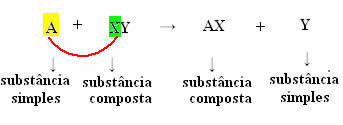
Toda da bi se to zgodilo, preprosta snov, v primeru, ki ga simbolizira A, mora biti bolj reaktiven kot element, ki bo izpodrivan iz spojine, se pretvori v novo preprosto snov (Y).
Oglejmo si primer, kjer pride do te reakcije:
Opazujte spodnji poskus, v katerem je list cinka (Zn) postavljen v vodno raztopino bakrovega sulfata (CuSO4). Sčasoma je opaziti, da se raztopina bakrovega sulfata iz modre barve spremeni v manj intenzivno modro, saj se je razbarvala in je na cinkovem listu nastal baker.

To reakcijo lahko predstavimo z uporabo naslednje kemijske enačbe:

Upoštevajte, da je cink izpodrinil baker, kar pomeni, da je cink najbolj reaktiven.
Ker sta obe kovini, lahko z analizo spojine preverimo, ali bo prišlo do preproste reakcije izmenjave ali ne čakalna vrsta kovinske reaktivnosti prikazano spodaj:

Upoštevajte, da je baker dejansko manj reaktiven od cinka, zato, če smo se odločili za nasprotno od prejšnjega eksperimenta in v raztopino cinkovega sulfata položite bakreno pločevino, do reakcije ne bi prišlo, saj baker ne bi mogel cink.
Reakcije izpodrivanja so vrsta redoks reakcije, saj pride do prenosa elektronov iz preproste snovi v kompozit. V zgoraj razloženem postopku je bil cink sprva v nevtralni obliki, ki je kovinska, in je postal del spojine, v kateri ima 2+ naboja, torej je vsak atom cinka izgubil dva elektroni. Z bakrom se zgodi ravno nasprotno, prejme dva elektrona, da preideta v kovinsko trdno stanje.
V primeru preproste reakcije izmenjave z nekovinami se upošteva: reakcija se bo zgodila le, če je najbolj reaktivna nekovina preprosta snov, ki lahko izpodrine drugo manj reaktivno nekovino. Reaktivnost ametalov je prikazana spodaj:

Avtorica Jennifer Fogaça
Diplomiral iz kemije
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/reacoes-deslocamento-substituicao-ou-simples-troca.htm