THEosmoza in prehod topila, iz manj koncentrirane raztopine v bolj koncentrirano raztopino skozi a polprepustna membrana, dokler pritisk raztopine na membrano ne prepreči prehajanja topila. Ta postopek naj bi uravnotežite koncentracijo raztopine.
Preberite tudi vi: Topilo in topilo
osmotski tlak
THE osmotski tlak in pritisk na raztopino z večjo koncentracijo tako da do osmoze ne pride, torej da topilo ne prečka polprepustne membrane.
Osmotski tlak se uporablja v procesih razsoljevanje vode, vsiljevanje procesa povratna osmoza, zaradi česar topilo prehaja iz bolj koncentrirane raztopine v manj koncentrirano. Temu pravimo postopek povratna osmoza. Oglejte si naslednjo sliko, ki primerja oba procesa:
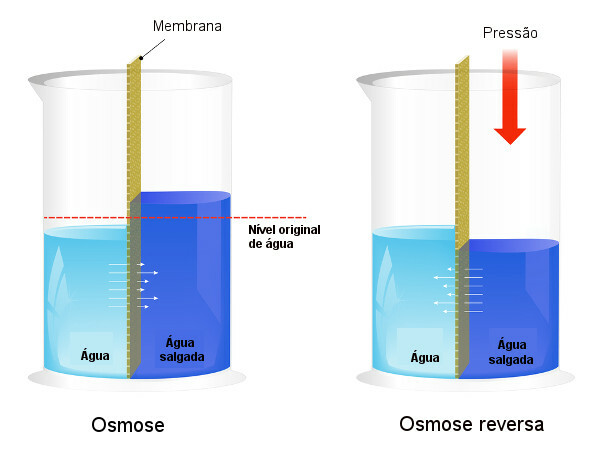
Upoštevajte, da je pri osmozi prehod topila v smeri najbolj koncentrirane raztopine in da je pri reverzni osmozi prehod v nasprotni smeri zaradi uporabljenega tlaka. Če želite izvedeti več o temi, preberite naše besedilo: osmotski tlak.
vedeti več: Reverzna osmoza pri razsoljevanju morske vode
enačba osmotskega tlaka
Osmotski tlak, ki ga predstavlja črka pi (π) raztopine, lahko izračunamo z naslednjo enačbo:
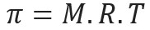
M = koncentracija v mol / L
R = univerzalna konstanta popolnih plinov
T = absolutna temperatura, v K
kot drugi koligativne lastnosti, osmotski tlak je odvisen od koncentracija raztopine, to je večja je koncentracija raztopine, večji je učinek osmoze na raztopine in zato večji osmotski tlak.
Primeri
Osmoza se pojavlja v našem vsakdanjem življenju ob različnih časih. Lahko navedemo primer postopek soljenja mesa svojemu ohranjanje. Ti mikroorganizmi kar bi povzročilo razgradnjo mesa izgubiti vodood znotraj navzven, ki ima koncentracijo soli, zaradi česar hrana dlje zdrži.
Zaradi soli se tudi zgodi, da listi solate posušijo za izgubo vode iz notranjosti celic (nekako manj koncentrirano) za kaljena raztopina v zunanjem okolju.
Ko govorimo o tem, je pomembna tudi osmoza kri človek. Pravimo, da Rdeče celice in kri je ena izotonični medij, to pomeni, da imajo enak osmotski tlak, ki omogoča vstop in izstop vode iz celice z lahkoto.
Ko pa postane kri manj koncentrirana kot znotraj rdečih krvnih celic (hipotonični medij), bo prehod vode lažje prišel znotraj celice, zaradi česar bo nabreknejo do razpoke. Če kri doseže koncentracijo, večjo od koncentracije rdečih celic (hipertonični medij), se krvne celice venejo, saj izgubljajo vodo.

Po istem načelu konzerviranja mesa je ohranjanje sadjav kompotih iz sladkarij, ki hrano ohranjajo zaradi visoka koncentracija sladkorja v raztopini.
Sledijo drugi primeri, ko se pojavi osmoza:
- v porastu soka v prevodnih posodah rastline;
- ob hemodializa;
- pri selektivnem prehajanju hranil v celicah človeškega telesa.
Če želite razumeti, kako se osmoza dogaja v živalski celici, rastlinski celici in druga biološka vprašanja, preberite: Osmoza: kaj je in kako se pojavlja v živalski in rastlinski celici.
Avtor Victor Ferreira
Učitelj kemije
