Kapaciteta, ki jo morajo povezave pritegniti električne naboje, je opredeljena kot polarnost, ki ima drugačen značaj, odvisno od povezave, kjer je.
Najpogostejše vezi, ki vključujejo organske spojine, se zgodijo med atomi ogljika ali med atomi ogljika in vodika: C ─ C in C ─ H (ogljikovodiki). To vrsto vezi uvrščamo med kovalentne, prisotna je v vseh vezah organskih spojin, ki jih tvorijo le ogljik in vodik.
Ko je v molekuli organske spojine poleg ogljika in vodika še en kemični element, bodo njegove molekule imele določeno polarnost. Temu elementu pravimo heteroatom in je med drugim lahko dušik (N), kisik (O).
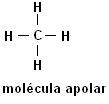
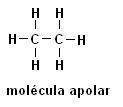
Metan (CH4) Etan (C2H6)
Upoštevajte, da v obeh strukturah ni heteroatomov, v tem primeru so molekule razvrščene kot nepolarne.


Zaradi prisotnosti kisika kot heteroatoma molekule kažejo polarnost. Prva molekula je spojina etanol (CH3CH2oh), prisotnost hidroksil - OH daje tej spojini polarni značaj, čeprav v svoji strukturi vsebuje nepolaren del.
Avtor Líria Alves
Diplomiral iz kemije
Brazilska šolska ekipa
Poglej več! ploski izomer
Organska kemija - Kemija - Brazilska šola
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/moleculas-organicas-polares-apolares.htm


