O Schrödingerjev atomski model je pogosta oblika, ki se uporablja za označevanje opis atoma z reševanjem Schrödingerjeve enačbe, ki jo je leta 1927 predlagal avstrijski fizik Erwin Schrödinger. Enačba je zasnovana na podlagi pomembnih opazovanj, pridobljenih v okviru kvantne mehanike, ki prinašajo trdno utemeljitev energije atoma in elektrona.
Atom, ki si ga je zamislil Schrödinger, temelji na dualnosti val-delec, na principu negotovosti, med drugimi pojmi, ki so bili skovani v začetku 20. stoletja. Prinesel je velik napredek k razumevanju materije, saj je utrl pot za trdnejše razumevanje polielektronskih atomov, kar ni mogoče z atomskim modelom, ki ga je predlagal Bohr.
Preberite tudi: Atomski modeli — modeli, predlagani za razlago zgradbe atoma
Povzetek o Schrödingerjevem atomskem modelu
Schrödingerjev atomski model je pravzaprav opis atoma in elektronov skozi Schrödingerjevo enačbo.
Schrödingerjeva enačba je bila razvita s pomembnimi študijami na področju kvantne mehanike.
Dvojnost val-delec, načelo negotovosti, med drugimi teorijami, so bili bistveni za ustvarjanje Schrödingerjeve enačbe.
Z reševanjem Schrödingerjeve enačbe je mogoče opisati tako energijo atoma kot tudi energijo elektrona.
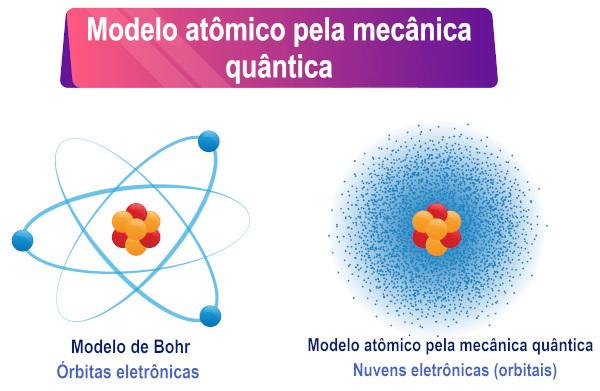
Na podlagi razlage Schrödingerjeve enačbe je razvidno, da elektroni nimajo točno določeno orbito okoli atoma, temveč območje verjetnosti obstoja okoli od njega.
Schrödingerjeve študije širijo razumevanje atoma, ki ga je predlagal Bohr, saj omogočajo razumevanje obnašanja polielektronskih atomov.
Kaj je Schrödingerjev atomski model?
Schrödingerjev atomski model je skupno ime za opis atomskega modela, ki temelji na kvantni mehaniki. Glavna značilnost tega modela je matematična interpretacija dualnosti val-delec, ki jo sprejmejo elektroni, več natančneje, zamenjava dobro definirane trajektorije elektrona z verjetnostjo obstoja elektrona okoli jedro.
Takšna interpretacija se je začela z delom avstrijskega znanstvenika Erwina Schrödingerja leta 1927, po pomembnem napredku pri razumevanju materije na področju kvantne mehanike, kot so fotoelektrični učinek, princip negotovosti in dualnost valovni delec.
Razumevanje Schrödingerjevega atomskega modela ni nepomembno, saj se mu približamo na naprednejših stopnjah študija kemije.
Eksperimentalna osnova za Schrödingerjev atomski model
Pred študijami Erwina Schrödingerja je prišlo do pomembnega napredka v razumevanje materije na začetku 20. stoletja. Takšni poskusi so začeli področje teoretičnega znanja, znanega kot kvantna mehanika, ki prinaša interpretacije o obnašanju delcev blizu ali pod atomsko lestvico. V tem specifičnem vesolju zakoni klasične fizike, znani tudi kot Newtonova fizika, pogosto ne veljajo ali ne zadostujejo za razlago določenih vedenj.
Da bi dobili predstavo, lahko rečemo, da se kvantna mehanika začne s temo, znano kot ultravijolična katastrofa. V skladu s klasično fiziko črno telo (vroč predmet) s temperaturo, različno od nič, poleg sevanja gama in rentgenskih žarkov oddaja tudi intenzivno ultravijolično sevanje.
To pomeni, da bi ljudje s svojo temperaturo 36-37 °C svetili v temi (posledica žarenja). Ni treba posebej poudarjati, da je to popolna neumnost, saj če bi bilo, ne bi bilo teme.
V tem kontekstu Leta 1900 je Max Planck ustvaril koncept koliko, prevedeno kot »paketi energije«, da bi pojasnili izmenjavo energije med snovjo in sevanjem. Po njegovi interpretaciji telo pri nizkih temperaturah (kot mi) nima dovolj energije za oddajanje visokofrekvenčnega ultravijoličnega sevanja.
Tako lahko telo oddaja visokofrekvenčno ultravijolično sevanje šele, ko pridobi minimalno potrebno energijo. V tem stanju poteka izmenjava energije med snovjo in okolico prek paketov energije sevanja.
Energetski paketi prinašajo tudi razliko v odnosu do klasične fizike. Ko govorimo o paketih energije, se nanaša na energijo, ki je kvantizirana, torej je specifična, obstaja uvedba omejitev. V Newtonovi fiziki količina izmenjane energije med dvema objektoma nima omejitev.
Fotoelektrični učinek
Za trdnost teorij, ki jih je predlagal Planck, je bilo potrebnih več dokazov. V tem kontekstu se je pojavil fotoelektrični učinek., ki se ukvarja z izbijanjem elektronov iz kovine z vpadom ultravijoličnega sevanja na njeno površino.
Glede na opažanja te teorije se elektroni ne izbijejo, dokler sevanje ne doseže frekvence določene vrednosti, specifične za vsako kovino. Ko je ta frekvenca dosežena, se elektroni takoj izbijejo in bolj kot je frekvenca vpadnega sevanja, hitrejši bo imel izbiti elektron.
A razlago za fotoelektrični učinek je podal Albert Einstein. Po Einsteinu je bilo elektromagnetno sevanje (svetloba je npr. elektromagnetno sevanje), ki se uporablja za izbijanje elektronov, sestavljeno iz delci, znani kot fotoni, in poleg tega bi lahko vsak foton interpretirali kot paket energije. Na podlagi Planckovih študij je bilo mogoče sklepati, da so fotoni ultravijoličnega sevanja bolj energični od fotonov vidne svetlobe.

Ob trku s površino kovine fotoni (sestavni deli elektromagnetnega sevanja) izmenjajo energijo s tam prisotnimi elektroni. Če je energija, ki jo elektron absorbira pri trčenju s fotoni, dovolj velika, potem bo izvržen. Če želite izvedeti več o fotoelektričnem učinku, kliknite tukaj.
dualnost val-delec
Fotoelektrični učinek je prinesel trdno osnovo, da je elektromagnetno sevanje sestavljeno iz delcev (fotonov). Vendar pa so številni drugi poskusi pokazali, da se elektromagnetno sevanje obnaša kot val. Od teh poskusov je bil najbolj osupljiv uklon – fizikalni pojav, ki ga opazimo, ko val naleti na oviro ali, po drugi razlagi, sposobnost valov, da premagajo ovire.
O Valovni značaj svetlobe je znan že od leta 1801, ko je angleški fizik Thomas Young osvetlil pregrado z režo. Ko gre skozi to režo, se svetloba ukloni. Pri vsaki reži, vključno s tisto, skozi katero svetloba prehaja, tudi ko se ukloni, je podvržena novemu uklonu.

Všečkaj to, bilo je treba sprejeti novo obnašanje elektromagnetnega sevanja: dualnost val-delec. Od tam je francoski znanstvenik Louis de Broglie razširil ta koncept in predlagal, da je treba vse delce razumeti kot valovno obnašanje.
De Brogliejeva hipoteza se je okrepila leta 1925, ko sta ameriška znanstvenika Clinton Davisson in Lester Germer je dokazal, da je elektronski žarek lahko podvržen uklonu, ko gre skozi posamezen kristal nikelj.
To dojemanje je bilo bistvenega pomena za zaključek, da so tudi težji delci, kot so molekule, sposobni doživeti uklon in se zato obnašati valovito. Če želite izvedeti več o dvojnosti val-delec, kliknite tukaj.
načelo negotovosti
V klasični fiziki vam je enostavno določiti trajektorijo delca. Vendar pa v kvantnem svetu, v katerem se delci prav tako obnašajo kot valovi, njihova trajektorija ni več tako natančna. To zato, ker nima smisla govoriti o lokaciji valovanja.
Na primer pri kitari, ko uberete struno, se val razširi po njeni celotni dolžini. Če ima delec enako obnašanje, njegove lokacije ni mogoče natančno določiti poznavanje njegove linearne količine (količina, ki meša maso in hitrost).
Zato elektron, ki ima tudi dvojni značaj, nima definirane orbite/poti okoli atomskega jedra, kot mnogi verjamejo. Advojnost nato ustvari negotovost glede natančnega položaja delca.
Ta negotovost v definiciji položaja je zanemarljiva za zelo težka telesa, vendar povsem pomembna za telesa atomske velikosti oz. subatomski, torej če veš, da je delec na določenem mestu, v določenem trenutku, ne boš več vedel, kje bo v naslednjem instant.
Iz te dileme je nastalo načelo negotovosti., ki ga je ustanovil nemški fizik Werner Heisenberg leta 1927. Po tem načelu ni mogoče poznati položaja in linearne količine delca brez meje napake, to je, če je ena lastnost znana, druga ni. Če želite izvedeti več o načelu negotovosti, kliknite tukaj.
Značilnosti Schrödingerjevega atomskega modela
Ker zaradi dvojne narave delca ni bilo več mogoče definirati specifične trajektorije zanj, je leta 1927 avstrijski znanstvenik Erwin Schrödinger je to natančno trajektorijo nadomestil z valovno funkcijo, ki ga predstavlja grška črka psi (ψ), pri čemer se vrednosti te funkcije spreminjajo glede na položaj. Primer valovne funkcije je sinusna funkcija x.
Znanstvenik Max Born je nato ustvaril fizično interpretacijo za valovno funkcijo, ki je izjavil, da je kvadrat funkcije ψ, to je ψ², bi bil sorazmeren z verjetnostjo, da najdemo delec v regiji. Tako se ψ² razume kot gostota verjetnosti, da najdemo delec v nekem območju. Ker gre za gostoto verjetnosti, je treba vrednost ψ² pomnožiti z volumnom, da dobimo pravo verjetnost.
Za izračun valovne funkcije je Schrödinger razvil enačbo, poenostavljeno na naslednji način:
Hψ = Eψ
Hψ je treba brati kot "psi hamiltonian" in opisuje ukrivljenost valovne funkcije. Hamiltonian je matematični operator, tako kot plus, minus, log itd. Desna stran nam prinaša ustrezno energijo.
Rešitev te enačbe nam prinese pomemben zaključek: delci imajo lahko samo diskretne energijes, to je dobro določene energije ali kvantizirane in ne katere koli vrednosti. Te posebne energijske vrednosti so znane kot energijske ravni. To je nalaganje valovne funkcije, saj se mora prilegati določenemu območju prostora. V klasični mehaniki ima lahko predmet poljubno vrednost celotne energije.
Všečkaj to, elektron ne more imeti nobene energije, vendar dobro opredeljene ravni energije. Ker mora valovna funkcija ustrezati območju prostora, ne pozabite, da a elektron je zaprt znotraj atoma s silami privlačnosti, ki jih ima za jedro.
Energijske ravni atoma je mogoče izračunati z ustrezno rešitvijo Schrödingerjeve enačbe. V tem primeru je opaziti, da ločljivost doseže novo enačbo, ki dokazuje, da je energija vsake ravni v atomu odvisna od celega števila, imenovanega n, kar potrjuje idejo, da imajo ravni energije določene vrednosti.
Tako dodeljevanje pozitivnih vrednosti n (1, 2, 3...), je mogoče izračunati energijo atomskih ravni. Parameter n se zdaj imenuje glavno kvantno število, saj je na koncu povezano z vsako atomsko ravnjo, dovoljeno za atom.
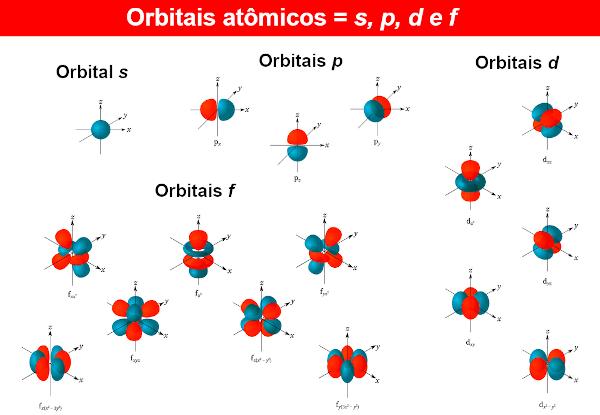
Za valovne funkcije elektronov imenujemo atomske orbitale, katerega matematične izraze dobimo tudi z reševanjem Schrödingerjeve enačbe. Atomska orbitala predstavlja porazdelitev elektrona v atomu, to je območje verjetnosti obstoja elektrona v atomu. Atomske orbitale imajo lahko različne oblike in energije, kar dobimo tudi s Schrödingerjevo enačbo.
Za vsako raven energije n (Spomnimo se tega n lahko 1, 2, 3 ...), obstajajo n podravni. V vsaki podravni so orbitale različnih oblik. Za različne orbitale ni omejitev, vendar pri doslej znanih atomih kemiki uporabljajo le štiri izmed njih, označene s črkami s, p, d je f.
Torej, na primer, na ravni n = 1, obstaja samo ena podnivo, torej obstaja samo orbitala s. Zdaj pa raven n = 2, obstajata dve podnivoji, orbitale so prisotne s je p.
Napredek Schrödingerjevega atomskega modela v primerjavi z drugimi atomskimi modeli
Kot rečeno, Schrödinger ni nujno predstavil modela, temveč matematično interpretacijo. za opazovane pojave v zvezi z naravo delcev. Zato postane njena interpretacija zapletena, saj sama Schrödingerjeva enačba potrebuje napredno matematično znanje za njeno razrešitev in celo za svojo interpretacijo.
Vendar pa je Schrödingerjeve študije so prinesle veliko robustnost za utemeljitev energije atomov in elektronov darila. Na primer, razrešitev Schrödingerjeve enačbe potrjuje Bohrov atomski model za vodikov atom in druge hidrogenoidne atome (tiste, ki imajo samo 1 elektron). Tako kot Schrödinger je tudi Bohr prišel do dovoljenih energijskih ravni vodikovega atoma.
Vendar pa Bohrov atomski model ne more doseči elektronskih ravni za atome z več kot 1 elektronom in tako kaže svojo glavno slabost. Ko sta prisotna dva elektrona, je treba upoštevati elektronski odboj med njima, parameter, ki ga lahko dodamo matematičnemu razumevanju, ki ga predlaga Schrödinger.
Druga pomembna točka Schrödingerjevih študij je prilagoditev kvantnih konceptov, kot je dualnost delca, pa tudi natančna trajektorija elektrona. Definicija atomske orbite je zelo pomembna za razumevanje struktura vseh atomov. A gostota verjetnosti (ψ²) nam pomaga razumeti, kako elektroni zasedajo atomske orbitale v polielektronskih atomih, kar prinaša bolj specifične informacije o energiji elektrona.
Avtor: Stefano Araujo Novais
Učiteljica kemije
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/modelo-atomico-de-schrodinger.htm
