Materija se lahko pretvori v dve glavni vrsti transformacije, fizikalno in kemično. Fizična preobrazba je takrat, ko se narava snovi, torej njena sestava, ne spremeni. Na primer, ko smo odrezali kos lesa, je bil ta preoblikovan, vendar je bil to fizični pojav, saj je še vedno les, njegova sestava je enaka kot na začetku.
Po drugi strani, pride do kemične preobrazbe ali pojava, ko se spremeni narava ali sestava snovi. V tem primeru so začetni delci (ki so lahko molekule, atomi, ionski grozdi, ioni itd.) Podobni razstavijo in njihovi atomi se preuredijo, sestavljajo nove molekule, grozde, atome, ione itd., to je nove snovi. To je kemijska reakcija.
Na primer, predstavljajte si, da osvetljeno vžigalico približamo etilnemu alkoholu. Vemo, kaj se bo zgodilo: alkohol bo začel goreti. To pomeni, da je podvržen kemični reakciji s kisikom v zraku (O2) in bo spremenil svojo sestavo, ne bo več etanol (C2H6O) in kisik tudi ne bo več imel začetne sestave, pri čemer bodo nastajale nove snovi, ki so ogljikov dioksid (CO2) in vodo (H2O).

Alkohol v ognju - reakcija zgorevanja
V kemijskih reakcijah se imenujejo začetne snovi reagenti in konec izdelkov, reakcije pa so predstavljene skozi kemijske enačbe, ki sledijo naslednji splošni strukturi:
REAGENTI → IZDELKI
Glede na prejšnji primer popolne reakcije izgorevanja alkohola (etanola) imamo naslednjo kemijsko enačbo:
Etanol + kisikov plin → Ogljikov dioksid + voda
Ta kemična reakcija je v nadaljevanju predstavljena z atomi po Daltonovem modelu v obliki preprostih kroglic:
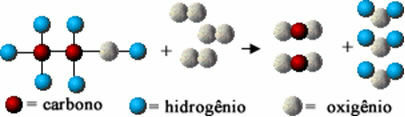
Modelna predstavitev reakcije izgorevanja etanola
Opazite, da so bile začetne vezi med atomi pretrgane in so tvorile nove vezi, ki so povzročile nove snovi.
Tako so kemijske enačbe napisane s pomočjo formul in simbolov, ki najbolje predstavljajo zgornjo shemo. V obravnavanem primeru (reakcija izgorevanja etanola) imamo, da je kemijska enačba izražena na naslednji način:
Ç2H5oh(?) + 3 O2 (g) → 2 CO2 (g) + 3 H2O(v)
Obstaja nekaj vizualnih dejavnikov, ki kažejo, da je prišlo do kemične reakcije, in sicer:
* Izpust plina;
* Sprememba barve;
* Nastajanje oborine;
* Videz plamena ali svetilnosti.
Pomembni procesi, ki se pojavljajo v našem telesu, v naravi in v panogah, kot je proizvodnja zdravil in industrializiranih živil, so kemične reakcije. Zato so izjemno pomembni za nastanek in vzdrževanje življenja.
Obstaja več vrst kemičnih reakcij, ki jih je mogoče razvrstiti glede na različna merila, vendar so glavne vrste, ki jih preučujejo v kemiji:
1. Anorganske reakcije: Običajno so razvrščeni glede na število nastalih snovi, število reagentov in prisotnost ali odsotnost enostavnih in sestavljenih snovi. Obstajajo štiri glavne vrste anorganskih reakcij:
1.1. Sintezne ali adicijske reakcije;
1.2. Reakcija razgradnje ali analize;
1.3. Preprosta izmenjava, premik ali redoks reakcija;
1.4. Dvojna izmenjava ali reakcija metateze;
2. Organske reakcije: To so tiste, ki vključujejo ogljikove spojine. Na splošno so razvrščeni v tri glavne vrste:
2.1. Reakcije seštevanja;
2.2. Nadomestne reakcije;
2.3. Reakcijske reakcije.
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Vir: Brazilska šola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-uma-reacao-quimica.htm

