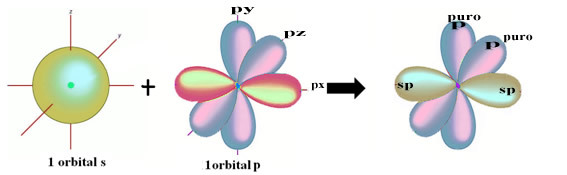
THE izomerija je pojav, ki ga opazimo, ko različne spojine tvorijo enake količine enakih vrst atomov.
Zato lahko najdemo kemične snovi z enako molekulsko formulo in različnimi strukturnimi formulami ali prostorsko razporeditvijo.
Ta pojav je pogosto opažen v organski kemiji, ki preučuje ogljikove spojine. Ker lahko vsak atom tega elementa ustvari 4 kemične vezi, je mogoče opaziti različne kombinacije.
Ker sprememba razporeditve atomov povzroči nastanek novih snovi, imajo posledično različne fizikalne in kemijske lastnosti.
Ko rečemo, katere spojine so izomeri pomeni, da imajo enake dele, saj je beseda kombinacija dveh izrazov grškega izvora: isos, pomeni "res" in samo, kar je "deli".
Dve glavni skupini izomerizma sta ravninska in prostorska (stereoizomerija).
THE ploska izomerija vizualiziramo ga lahko s ploščato strukturno formulo spojin in ima pet razredov: položaj, funkcijo, verigo, kompenzacijo in tavtomerijo.
THE izomerija prostora opazujemo ga glede na orientacijo spojin in se deli na geometrijsko (cis-trans) in optično.
Koncept izomerizma je leta 1830 uvedel švedski znanstvenik Jacob Berzelius.
Primeri izomerov
THE verižna izomerija pojavi se, ko se isti niz atomov poveže v strukture iste funkcionalne skupine, vendar z različnimi verigami.
Primer: molekulska formula C4H10 ogljikovodika je lahko ravna ali razvejena.

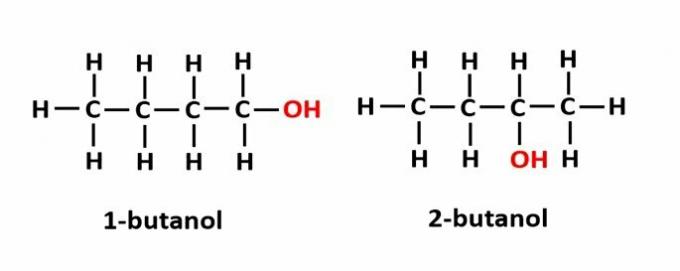
THE položajna izomerija se pojavi, ko spojine tvorijo iste funkcionalne skupine, vendar so na različnih položajih v verigi.
Primer: Molekulska formula C4H9OH ustreza dvema vrstama alkohola.
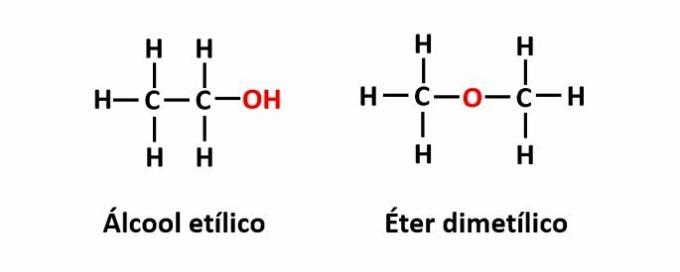
THE izomerija funkcije se pojavi, ko enaka molekulska formula ustreza dvema spojinama z različnimi funkcionalnimi skupinami.
Primer: Molekulska formula C2H6O ustreza dvema izomeroma, ki imata funkciji alkohola (-OH) in etra (-O-).
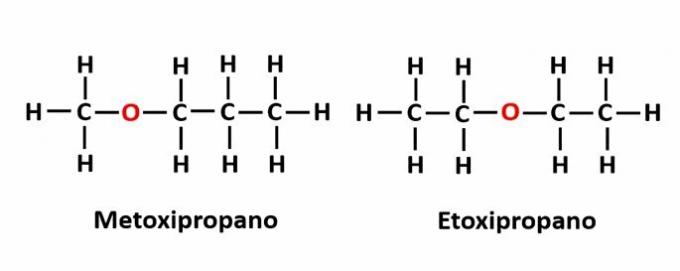
THE kompenzacijski izomerizem pojavi se, ko je v verigi heteroatom in zavzema različne položaje. To je poseben primer izomerizma položaja.
Primer: Molekulska formula C4H10Označuje prisotnost atoma kisika v verigi, vendar se lahko njegov položaj spremeni in tvori različne spojine.
THE dinamična izomerija, imenovana tudi tavtomerija, se pojavi, ko sta dve spojini z različnimi funkcijami v isti raztopini v dinamičnem ravnovesju. To je poseben primer izomerizma funkcij.
Primer: Molekulska formula C2H4O ustreza spojinam z aldehidno in enolno funkcijo.
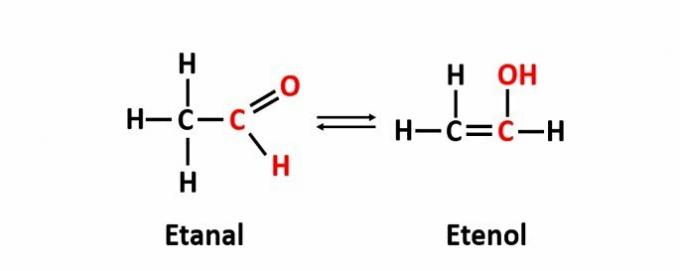
Več o tem ploska izomerija.
THE geometrijska izomerija, imenovan tudi izomerija cis-trans, se pojavi, ko prisotnost dvojne vezi ali ciklične strukture povzroči, da so enaki ligandi na isti strani ravnine (cis) ali na nasprotnih straneh (trans).
Primer: atomi klora v spojinah z molekulsko formulo C2H2Cl2 imajo lahko dve prostorski strukturi.
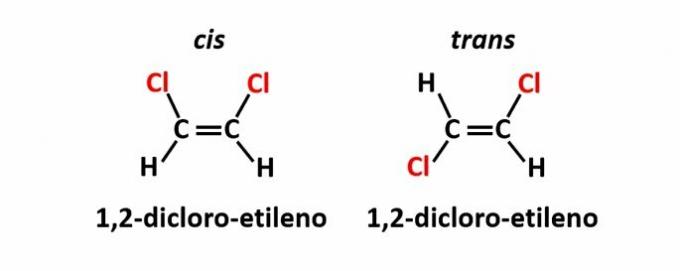
THE optična izomerija se pojavi, ko spojine pri odklonu polarizirane svetlobe, oddane na strukturi, uspejo odkloniti žarek sveti na levo, če je levorotacijski (l) izomer, ali na desno, če je desnorotacijski izomer (d).
Primer: Ta vrsta izomerizma se pojavi pri mlečni kislini. Spodaj upoštevajte, da se spektralne slike izomerov ne prekrivajo, zato jih imenujemo enantiomeri.
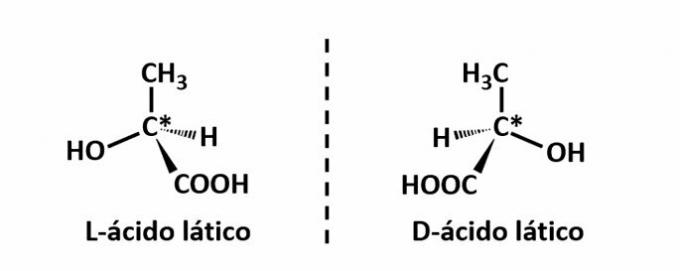
Simbol C* označuje prisotnost kiralnega ogljika v tej strukturi, torej ogljikovega atoma s 4 različnimi povezovalci.
Več o izomerizmu z vsebino:
- Vrste izomerizma
- vesoljski izomer
- geometrijski izomer
- optični izomer
- Vaje o ravninski izomeriji