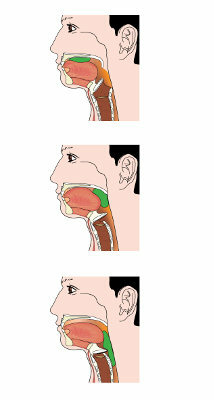
eno polarna spojina (ali snov) je tista, ki ima dve regiji z različno elektronsko gostoto. Eno od teh regij ima pozitiven značaj (belo območje), drugo pa negativno (rumeno območje), kot lahko vidimo v naslednjem prikazu:

Predstavitev območij različnih nabojev v polarni spojini
Vedite, če določena kompozit je polarni pomeni poznavanje vrste medmolekularne sile, ki daje prednost interakciji med njenimi molekulami ali z molekule drugih snovi, kot tudi predpostavke o njihovi topnosti in tališčih ter Vreti.
Na primer: glede topnosti imajo polarne spojine dobro sposobnost raztapljanja v polarne spojine. Kar zadeva medmolekularne sile, lahko polarne spojine, odvisno od primera, medsebojno delujejo s silami trajne dipolne ali vodikove vezi (moč, ki ima za posledico tudi višje tališče in Vreti).
Tukaj sta dva praktična načina, kako ugotoviti, ali je spojina polarna ali ne.
Določanje polarnosti preko števila oblakov in števila ligandov
Lahko ugotovimo, ali a kompozit je polarni z razmerjem med številom enakih atomov, vezanih na osrednji atom, in številom elektronskih oblakov v tem osrednjem atomu.
Opomba: Elektronski oblak je katera koli kemična vez med dvema atomoma ali par elektronov iz valenčne lupine atoma, ki ne sodelujeta v vezi.
Če se število oblakov v osrednjem atomu razlikuje od števila enakih ligandov v tem osrednjem atomu, imamo polarno spojino. Za boljše razumevanje sledite spodnjim primerom:
1. primer: Molekula cianovodikove kisline
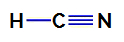
Strukturna formula cianovodikove kisline
V cianovodikovi kislini je osrednji atom ogljik, ki ima v sebi štiri elektrone valenčni sloj za pripadnost družini IVA periodnega sistema. Kako ogljik tvori enojno vez (s deli dva elektrona, z enim elektronom iz vsakega atoma vključen) z vodikom in trojno vezjo z dušikom, tako da v atomu ni elektronov, ki ne vežejo osrednji.
Tako je v cianovodikovi kislini prisotna dva elektronska oblaka (enojna vez in trojna vez) in ligand, enak drugemu. Zato je a polarna spojina.
2. primer: Molekula amoniaka (NH3)
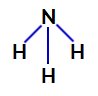
Strukturna formula amoniaka
V amoniaku je osrednji atom dušik, ki ima pet elektronov v svoji valenčni lupini, saj spada v družino VA periodnega sistema. Ker dušik tvori enojno vez (souporaba dveh elektronov, z enim elektronom od vsak vključen atom) z vsakim atomom vodika dva od njegovih petih elektronov ne sodelujeta v vezi.
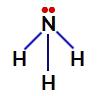
Elektroni, ki ne vežejo dušika v amoniaku
Tako so v amoniaku štirje elektronski oblaki (tri enojne vezi in nevezni elektronski par) in trije enaki ligandi (tri vodiki). Torej je a polarna spojina.
Ne nehaj zdaj... Po reklami je še več ;)
Določanje polarnosti preko vektorja dipolnega momenta spojine
Lahko ugotovimo, ali a kompozit je polarni z analizo nastali vektor dipolnega momenta v svoji strukturni formuli, ob upoštevanju njene molekularna geometrija in razlika med elektronegativnost med vpletenimi atomi.
Opomba: Padajoči vrstni red elektronegativnosti elementov: F > O > N > Cl > Br > I > S > C > P > H.
Ko je vsota vektorjev, prisotnih v molekuli, drugačna od nič, bo spojina polarna. Za boljše razumevanje sledite naslednjim primerom:
1. primer: molekula triklorometana
Triklorometan je spojina, ki predstavlja tetraedrska geometrija, kot lahko vidimo v njegovi strukturni formuli spodaj:

Strukturna formula triklorometana
Da ugotovimo, ali gre za polarno spojino ali ne, moramo vektorje dipolnega momenta (puščice, ki označujejo, kateri atom je bolj stabilen od drugega) najprej postaviti v strukturnega, kot v naslednjem primeru:
Opomba: Klor je bolj elektronegativen element kot ogljik. Po drugi strani je ogljik bolj elektronegativen element kot vodik.
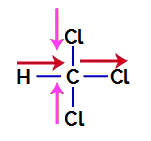
Vektorji dipolnega momenta v triklorometanu
Vektorje v roza barvi lahko predstavimo z +x in -x, saj imajo isto smer (navpično) in nasprotni smeri (gor in dol). Rdeči vektorji so predstavljeni z +x, saj imajo isto smer in isto smer. Tako je dobljeni vektor dipolnega momenta (vsota vektorjev) predstavljen z:
μr = (+x) + (-x) + (+x) + (+x)
μr = +X – x + x + x
μr = 2x
Ker je dobljeni vektor dipolnega momenta drugačen od nič, imamo a polarna spojina.
2. primer: molekula vode
Voda je spojina, ki predstavlja kotna geometrija, kot lahko vidimo v njegovi strukturni formuli spodaj:
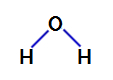
Strukturna formula vode
Da ugotovimo, ali je polarna spojina ali ne, moramo najprej postaviti vektorje dipolnega momenta (puščice, ki kažejo, kateri atom je stabilnejši od drugega) v strukturo, kot je prikazano spodaj:
Opomba: Kisik je bolj elektronegativen element kot vodik.
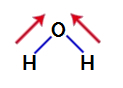
vektorji dipolnega momenta v vodi
Ker sta dva vektorja v strukturi vode diagonalno, moramo uporabiti pravilo paralelograma. V tem pravilu, ko povežemo baze vektorjev, imamo ustvarjanje nastalega vektorja (ki nadomešča prej uporabljena dva), kot v naslednjem modelu:
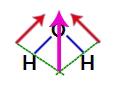
Nastali vektor v strukturni formuli vode
Ker ima molekula vode en sam vektor, je dobljeni vektor dipolnega momenta enak nič, torej imamo polarna spojina.
Jaz, Diogo Lopes Dias
Ali se želite sklicevati na to besedilo v šolskem ali akademskem delu? Poglej:
DNI, Diogo Lopes. "Kaj je polarna spojina?"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-um-composto-polar.htm. Dostop 27. julija 2021.