Pri reakcije zgorevanja prisotni so v mnogih vidikih našega vsakdanjega življenja. Na primer, glavni viri proizvodnje energije so posledica zgorevanja ali zgorevanja nekaterih goriv, kot so etanol, bencin, oglje, med drugim. Poleg tega je energija, ki jo potrebujemo za preživetje in opravljanje dela, posledica reakcij zgorevanja, ki se odvijajo v naših celicah, ko »zažgemo« hrano, ki jo zaužijemo.
Toda kaj je potrebno za reakcijo zgorevanja?
Potrebne so tri stvari:
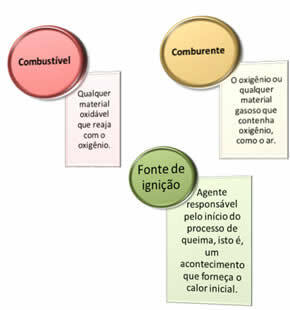
Ti trije dejavniki sestavljajo ognjeni trikotnik, ker ko se reakcija zgorevanja začne, sproščena energija vzdržuje reakcijo in ji omogoča nadaljevanje, dokler ne izgine gorivo, oksidant ali toplota (sproščena energija). To pomeni, da bo a Verižna reakcija.
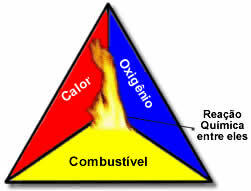
Na primer, če nekdo vrže prižgano cigareto v gozd, bo prišlo do požara (reakcija zgorevanja). V tem primeru je Bush to je gorivo, O kisik prisoten v zraku atmosfersko je oksidant to je cigareta prižgal je bil vir vžiga. To gorenje se bo nadaljevalo, dokler ne bo odpravljen eden od treh dejavnikov. Če gasilci vržejo vodo, bo toplota odpravljena. A tudi če se ne naredi nič, da bi to gorenje ustavili, se bo v nekem trenutku končalo, torej ko bo goriva (gozd) zmanjkalo.
Kot smo že omenili, se pri teh reakcijah sprošča toplota, zato je zgorevanje eksotermna reakcija. Vendar je ta vrsta reakcije nepopolno zgorevanje. Če želite razumeti, zakaj, si oglejte razliko med popolnim in nepopolnim zgorevanjem:
Popolno zgorevanje:
Pri analizi organskih spojin kot goriv moramo:
| THE popolno zgorevanje pojavi se, ko je ogljikova veriga prekinjena in so vsi ogljikovi atomi v ogljikovi verigi popolnoma oksidirani. |
| ti oblikovani izdelki z ogljikovodiki bo CO2 (ogljikov dioksid) in H2O (voda). |
Opazujte popolno zgorevanje izooktana, ki je ena od sestavin bencina.
Ç8H18 (g) +25/2 O2 (g) → 8 CO2 (g) + 9 ur2O(1)
nepopolno zgorevanje
| V tem primeru ni dovolj oksidanta, torej dovolj kisika, da bi zgorelo vse gorivo. |
| Tako so nastali produkti CO (ogljikov monoksid) in H2O. |
Opazujte enako zgorevanje izoktana, vendar zdaj nepopolno:
Ç8H18 (g) + 17/2 O2(g) → 8 CO (g) + 9 ur2O(1)
Primer je kurjenje gozdov, saj so nastale emisije sestavljene iz CO in posebnih snovi, kot so saje (C), ter pepela in drugih preprostih in zapletenih organskih spojin. Dušikov oksid, ozon in aldehidi lahko nastanejo tudi kot posledica sekundarnih reakcij zaradi prisotnosti drugih sestavin v zraku.
Ç8H18 (g) + 9/2 O2 (g) → 8C (g) + 9 ur2O(1)
Avtor: Jennifer Fogaça
Diplomirala iz kemije
Šolska ekipa Brazilije
vir: brazilska šola - https://brasilescola.uol.com.br/quimica/combustao-completa-incompleta.htm

