Kemična izomerija je pojav, ki ga opazimo, kadar imata dve ali več organskih snovi enako molekulsko formulo, vendar različno molekularno strukturo in lastnosti.
Kemične snovi s temi lastnostmi se imenujejo izomeri.
Izraz izhaja iz grških besed iso = enako in zgolj = deli, torej enaki deli.
Obstajajo različne vrste izomerije:
- ploski izomer: Spojine so identificirane s ploščatimi strukturnimi formulami. Razdeljen je na verižno izomerijo, funkcijsko izomerijo, pozicijsko izomerijo, kompenzacijsko izomerijo in tavtomerijo.
- vesoljski izomer: Molekularna struktura spojin ima različne prostorske strukture. Razdeljen je na geometrijsko in optično izomerijo.
ploski izomer
Ob ploska izomerija ali ustavna izomerija, je molekularna struktura organskih snovi ravna.
Spojine, ki kažejo to lastnost, se imenujejo ploski izomeri.
verižni izomer
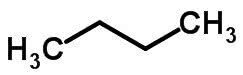
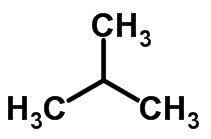
Verižna izomerija se zgodi, kadar imajo atomi ogljika različne verige in enako kemijsko funkcijo.
Primeri:
Izomerija funkcije
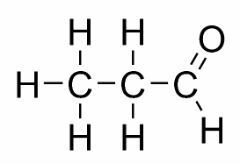
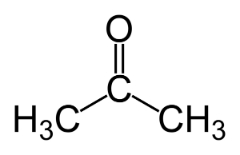
Izomerija funkcije se pojavi, kadar imata dve ali več spojin različne kemijske funkcije in enako molekulsko formulo.
Primeri: Ta primer je pogost med aldehidi in ketoni.
Položajni izomer
Položajna izomerija se pojavi, kadar se spojine razlikujejo po različnih nenasičenih, razvejanih ali funkcionalnih skupinah v ogljikovi verigi. V tem primeru imajo izomeri enako kemijsko funkcijo.
Primeri:

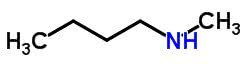
kompenzacijski izomer
Kompenzacijska izomerija ali metamerizem se pojavita v spojinah z enako kemijsko funkcijo, ki se razlikujejo po položaju heteroatomov.
Primeri:

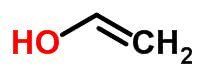
Tavtomerija
Tavtomerija ali dinamična izomerija se lahko šteje za poseben primer funkcijske izomerije. V tem primeru se lahko en izomer spremeni v drugega s spreminjanjem položaja elementa v verigi.
Primeri:

vesoljski izomer
THE vesoljska izomerija, imenovano tudi stereoizomerija, se zgodi, kadar imata dve spojini enako molekulsko formulo in različni strukturni formuli.
Pri tej vrsti izomerije so atomi porazdeljeni enako, vendar zasedajo različne položaje v prostoru.
geometrijski izomer
THE geometrijska izomerija ali cis-trans se pojavlja v nenasičenih odprtih verigah in tudi v cikličnih spojinah. Da bi to naredili, morajo biti ogljikovi ligandi drugačni.

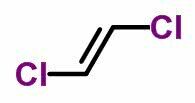
- Ko so isti ligandi na isti strani, izomerska nomenklatura prejme predpono cis.
- Ko so isti ligandi na nasprotnih straneh, nomenklatura prejme predpono trans.
IUPAC (Mednarodna zveza čiste in uporabne kemije) priporoča, da se namesto cis in trans črki Z in E uporabljata kot predponi.
To je zato, ker je Z prva črka nemške besede zusammen, kar pomeni "skupaj". In to je prva črka nemške besede entegegen, kar pomeni "nasprotno".
optični izomer
THE optična izomerija dokazujejo spojine, ki so optično aktivne. To se zgodi, kadar snov povzroči kotno odstopanje v ravnini polarizirane svetlobe.
- Ko snov upogne optično svetlobo v desno, jo imenujemo desničar.
- Ko snov upogne optično svetlobo v levo, se snov pokliče levorotary.
Snov lahko obstaja tudi v dveh optično aktivnih oblikah, dextogyra in levogyra. V tem primeru se imenuje enantiomer.
Da je ogljikova spojina optično aktivna, mora biti kiralna. To pomeni, da se njihovi ligandi ne morejo prekrivati in so asimetrični.
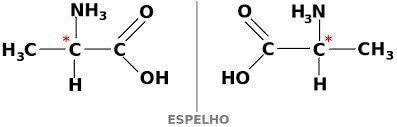
Če pa ima spojina dekstrogiro in levorotarno obliko v enakih delih, jih imenujemo racemične mešanice. Optična aktivnost racemičnih zmesi je neaktivna.
Preberite tudi:
- Ogljik
- Organska kemija
- Molekularna formula
- strukturna formula
Vaje
1. (Mackenzie 2012) Številčni stolpec B, ki vsebuje organske spojine in jih poveže s stolpcem A, glede na vrsto izomerije, ki jo predstavlja vsaka organska molekula.
Stolpec A
1. kompenzacijski izomer
2. geometrijski izomer
3. verižni izomer
4. optični izomer
Stolpec B
() ciklopropan
() etoksi-etan
() bromo-kloro-fluoro-metan
() 1,2-dikloro-eten
Pravilno zaporedje številk v stolpcu B, od zgoraj navzdol, je
a) 2 - 1 - 4 - 3.
b) 3 - 1 - 4 - 2.
c) 1 - 2 - 3 - 4.
d) 3 - 4 - 1 - 2.
e) 4 - 1 - 3 - 2.
Alternativa b) 3 - 1 - 4 - 2.
2. (Uerj) Izomerija je pojav, za katerega je značilno, da ista molekulska formula predstavlja različne strukture.
Upoštevajoč ravno strukturno izomerijo molekulske formule C4H8, lahko prepoznamo izomere naslednjih vrst:
a) veriga in položaj
b) veriga in delovanje
c) delovanje in kompenzacija
d) položaj in nadomestilo
Alternativa a) niz in položaj
3. (OSEC) Propanon in izopropenol ponazarjata primer izomerije:
a) metamerije
b) funkcije
c) tavtomerije
d) cis-tran
e) veriga
Alternativa c) tavtomerije
Glej tudi: Vaje za ravno izomerijo