Čisto snov tvori ena vrsta kemičnih vrst, to je njena sestava in lastnosti so določene. Mešanica vsebuje več kot eno vrsto komponent, zato se njena organizacija razlikuje.
Tako lahko čisto snov ločimo od zmesi šele, ko poznamo njeno sestavo.
Ko primerjamo kozarec vode in kozarec raztopljenega sladkorja, naše oči ne opazijo nobene razlike. Če pa zaužijemo vsebino obeh kozarcev, bomo opazili, da je eden čista snov, drugi pa je sestavljen iz mešanice.
čiste snovi
Čista snov je nabor samo ene kemične vrste, torej ni mešana z drugimi.
Za primer uporabimo vodo. Voda (H2O) je prepoznaven po svojih značilnostih in posebne lastnosti tega materiala nam pomagajo, da ga prepoznamo. Glavni lastnosti vode so:
| Gostota | 1,00 g / cm3 |
|---|---|
| Fuzijska točka | 0 ° C |
| Vrelišče | 100 ° C |
Kadar ima material v celoti fiksne in nespremenljive lastnosti, rečemo, da je čista snov.
Ko v kozarec vode damo kuhinjsko sol, natrijev klorid (NaCl) in premešamo, bo prišlo do spremembe.

Rezultat je izdelek z vmesno gostoto med gostoto vode in soli. To je zato, ker voda ni več čista snov in je postala Zmešajte.
Ko poskušate zamrzniti to mešanico, boste opazili, da bo temperatura taljenja nižja od 0 ° C in to tudi ta zmes ne bo vrela pri 100 ° C, za izhlapevanje bo potrebno več toplote izdelka.
Čiste preproste in sestavljene snovi
Čiste snovi so razvrščene kot enostavne, če so v njihovi sestavi atomi samo enega kemičnega elementa.
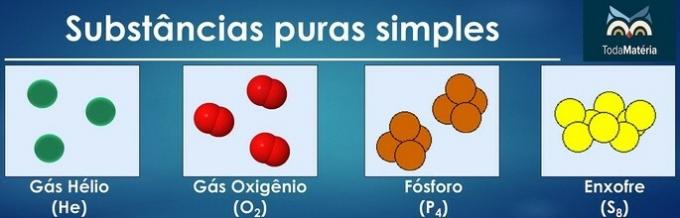
Razporeditev atomov dveh ali več kemičnih elementov tvori čiste sestavljene snovi.

Mešanice
Mešanica ustreza povezovanju dveh ali več čistih snovi, ki jih imenujemo sestavine.
Za razliko od čistih snovi njegove lastnosti niso fiksne, saj so odvisne od deleža komponent v mešanici.
Oglejte si, kako se gostota, fizikalna lastnost, spreminja glede na količino soli, pomešane z vodo.
| Odstotek soli v skupna masa zmesi |
Gostota zmesi (g / cm3) pri 20 ° C |
|---|---|
| 1 | 1,005 |
| 8 | 1,056 |
| 12 | 1,086 |
| 16 | 1,116 |
| 26 | 1,197 |
Vir: FURNISS, B. S. et al. Voglov učbenik praktične organske kemije. 4. izd. London: Longman, 1987. P. 1.312.
Zato ima dodatek vode in soli v katerem koli razmerju spremenljivo gostoto, zato mešanice ne moremo uvrstiti niti med vodo niti kot sol.
Homogene in heterogene mešanice
Homogene mešanice so tiste, ki predstavljajo komponente samo v eni fazi in zato imajo enake lastnosti na vseh točkah.

Ko vizualno zaznamo več kot eno fazo, potem je zmes razvrščena kot heterogena.

Povzetek čistih snovi in zmesi
| Čiste snovi in zmesi | |
|---|---|
|
homogen sistem (samo ena faza) |
čista snov (ena komponenta) |
|
homogena zmes (več kot ena komponenta v isti fazi) | |
|
heterogeni sistem (več kot ena faza) |
čista snov (komponenta v različnih agregatnih stanjih) |
|
heterogena mešanica (več kot ena komponenta v več kot eni fazi) |
Če želite izvedeti več, preverite ta besedila:
- Atomi
- Kemični elementi
- Ločevanje zmesi
Vaje s komentiranimi povratnimi informacijami
1. (UFMG) Vzorcu čiste snovi X so bile določene nekatere lastnosti. Vse alternative imajo lastnosti, ki so koristne za identifikacijo te snovi, razen:
a) gostota.
b) masa vzorca.
c) topnost v vodi.
d) temperatura vrelišča.
e) temperatura taljenja.
Napačna alternativa: b) masa vzorca.
a) PRAVILNO. Gostota je količina snovi v določeni prostornini. Kot materialno značilna lastnost je koristna za identifikacijo snovi.
b) NAPAK. Masa je količina snovi v telesu. Ker ta lastnost velja za katero koli snov, ne glede na njeno sestavo, je ni mogoče uporabiti za identifikacijo snovi.
c) PRAVILNO. Topnost je sposobnost snovi, da se v dani tekočini raztopi ali ne. Kot materialno značilna lastnost je koristna za identifikacijo snovi.
d) PRAVILNO. Temperatura vrelišča ustreza temperaturi prehoda iz tekočega v plinasto stanje. Kot materialno značilna lastnost je koristna za identifikacijo snovi.
e) PRAVILNO. Temperatura taljenja ustreza temperaturi prehoda iz tekočega v trdno stanje. Kot materialno značilna lastnost je koristna za identifikacijo snovi.
2. (Vunesp) Oznaka steklenice mineralne vode je prikazana spodaj.
| Verjetna kemična sestava: |
|---|
| Kalcijev sulfat 0,0038 mg / L |
| Kalcijev bikarbonat 0,0167 mg / l |
Na podlagi teh informacij lahko mineralno vodo razvrstimo med:
a) čista snov.
b) preprosta snov.
c) heterogena mešanica.
d) homogena zmes.
e) koloidna suspenzija.
Pravilna alternativa: d) homogena zmes.
a) NAPAK. Voda bi bila čista, če bi imela v svoji sestavi le molekule H2O.
b) NAPAK. Preprosta snov je sestavljena iz atomov samo enega kemičnega elementa. Čista voda tudi ni preprosta snov, saj jo tvorijo atomi vodika in kisika (H2O) je razvrščen kot sestavljen.
c) NAPAK. Heterogena zmes ima več kot eno fazo, v tem primeru lahko opazujemo samo vodo.
d) PRAVILNO. Ker ima samo eno fazo, je sistem homogen. Ob pogledu na steklenico z vodo lahko vidimo le tekočino, saj sta kalcijev sulfat in kalcijev bikarbonat spojina topna v vodi in se zato raztapljata.
e) NAPAK. Koloidna suspenzija je heterogena zmes, katere komponente se razlikujejo z mikroskopom.
3. (UCDB) V kemijskem laboratoriju so pripravili naslednje zmesi:
JAZ. voda / bencin
II. voda / sol
III. voda / pesek
IV. bencin / sol
V. bencin / pesek
Katere od teh zmesi so homogene?
a) Nobena.
b) Samo II.
c) II in III.
d) I in II.
e) II in IV.
Pravilna alternativa: b) Samo II.
a) NAPAK. Voda je anorganska spojina, bencin pa organska spojina. Te snovi nimajo sposobnosti interakcije in ker imajo različno gostoto, tvorijo heterogeno zmes.
b) PRAVILNO. Sol, natrijev klorid, se raztopi v vodi in tvori raztopino, ki je homogena zmes.
c) NAPAK. Pesek, silicijev dioksid, tvori heterogeno zmes z vodo.
d) NAPAK. Sol je anorganska spojina, bencin pa organska spojina. Te snovi nimajo sposobnosti interakcije in ker imajo različno gostoto, tvorijo heterogeno zmes.
e) NAPAK. Pesek je anorganska spojina, bencin pa organska spojina. Te snovi nimajo sposobnosti interakcije in zato tvorijo heterogeno zmes.
4. (Ufes) V dobro mešanem sistemu, ki ga sestavljajo pesek, sol, sladkor, voda in bencin, je število faz:
a) 2.
b) 3.
c) 4.
d) 5.
e) 6.
Pravilna alternativa: b) 3.
FAZA 1: Sol in sladkor sta sposobna interakcije z vodo in prek medmolekularnih sil se molekule vežejo in tvorijo raztopino, ki je homogena zmes.
FAZA 2: Voda je anorganska spojina, bencin pa organska spojina. Te snovi nimajo sposobnosti interakcije in ker imajo različno gostoto, tvorijo heterogeno zmes.
3. FAZA: Pesek je silikat, ki nima kemijske afinitete z vodo in bencinom, zato predstavlja fazo.
5. (Mackenzie) Zmes, ki jo tvorijo:
a) kocke ledu in vodna raztopina sladkorja (glukoza).
b) N plinov2 in CO2.
c) voda in aceton.
d) voda in kosmuljev sirup.
e) kerozin in dizelsko olje.
Pravilna alternativa: a) kocke ledu in vodna raztopina sladkorja (glukoza).
a) PRAVILNO. Opaziti je mogoče dve fazi: ledene kocke in raztopino glukoze, zato so hetegen sistem.
b) NAPAK. Plini so vedno homogena zmes.
c) NAPAK. Vodikove vezi se tvorijo med karbonilom propanona in molekulo vode. Ker so polarne snovi, se aceton lahko topi v vodi in tvori homogeno zmes.
d) NAPAK. Ti dve komponenti se premešata in tvorijo homogen sistem, saj bomo iz kosmuljevega sirupa videli le rdečo tekočino, saj z dodajanjem vode pride do razredčenja.
e) NAPAK. Obe sta organski spojini in zaradi kemijske afinitete tvorita eno fazo, ki predstavlja homogen sistem.
Preizkusite svoje znanje z vajami:
- Vaje na homogenih in heterogenih mešanicah
- Vaje za ločevanje zmesi
- Vaje o lastnostih snovi