Eksperimenti so praktičen način, da se naučite in preizkusite svoje znanje konceptov, ki jih preučujete v kemiji.
Izkoristite te kemijske poskuse, ki jih lahko opravite doma (pod nadzorom odrasle osebe) ali jih skupaj z učiteljem opravite v učilnici, da dopolnite svoj študij.
1. izkušnja - razkrivanje barv
Vključeni pojmi: kromatografija in ločevanje zmesi
Materiali
- pisala (označeni markerji) različnih barv
- alkohol
- kavni filtrirni papir
- skodelica (kozarec za lažje spremljanje poskusa)
Kako narediti
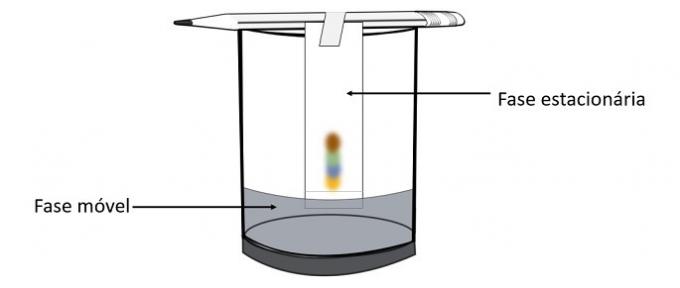
- Uporabite škarje in izrezane trakove filtrirnega papirja. Za vsak uporabljen pisalo naredite pravokotnik.
- Zdaj na razdalji približno 2 cm od podlage z izbranim barvnim pisalom narišite krog in pobarvajte vso notranjost.
- Rob papirja, ki je najbolj oddaljen od narisanega marmorja, prilepite na nosilec. Za to lahko uporabite trak in ga pritrdite na svinčnik.
- V skodelico dodajte alkohol, ne preveč, saj naj se dotika samo konca papirja blizu oznake peresa.
- Papir položite v skodelico, tako da je navpična. Svinčnik, ki ga podpira, naj leži na robovih.
- Počakajte med 10 in 15 minutami, da se alkohol dvigne skozi filtrirni papir. Po tem odstranite papirje in jih pustite, da se posušijo.
Rezultat
Ko alkohol prehaja skozi pisalo, sodeluje z barvnimi komponentami in jih poganja po papirju. Tako se bodo različni pigmenti ločili v stiku z alkoholom.
S tem poskusom je mogoče vedeti, katere barve so bile mešane, da so ustvarili barvo pisala.
Pojasnilo
Kromatografija je vrsta postopka za ločevanje zmesi. Filtrski papir je stacionarna faza, alkohol pa mobilna faza, ki vleče sestavine mešanice med prehodom skozi stacionarno fazo. V tem procesu je večja interakcija z alkoholom, hitreje se bo pigment premikal s prehodom topila.
Sestavine materiala, ki imajo različne lastnosti, bodo medsebojno vplivale na mobilno fazo na različne načine, kar lahko opazimo po različnih časih vlečenja v mirujoči fazi.
Več o kromatografija.
2. izkušnja - konzerviranje hrane
Vključeni pojmi: organske spojine in kemijske reakcije
Materiali
- jabolko, banano ali hruško
- limonin ali pomarančni sok
- Tableta vitamina C.
Kako narediti
- Izberite enega od treh sadežev in ga razrežite na 3 enake dele.
- Prvi kos bo služil kot primerjava z ostalimi. Zato mu ne dodajte ničesar, pustite ga izpostavljenega zraku.
- V enega od koščkov kapnite vsebino limone ali pomaranče. Razporedite tako, da je celotna notranjost sadja prekrita s sokom.
- V zadnjem delu namažite vitamin C, lahko je zdrobljena tableta, po celotni sadni kaši.
- Oglejte si, kaj se zgodi, in primerjajte rezultate.
Rezultat
Celuloza sadja, ki je bilo izpostavljeno zraku, naj hitro potemni. Limonin ali pomarančni sok in vitamin C, kemikalija, imenovana askorbinska kislina, bi morali upočasniti porjavitev plodov.

Pojasnilo
Ko sadje razrežemo, so njegove celice poškodovane in sproščajo encime, kot je polifenol oksidaza, ki v v stiku z zrakom fenolne spojine v hrani oksidirajo in povzročijo encimsko porjavenje.
Da bi preprečili delovanje kisika, se uporabljajo konzervansi, kot je askorbinska kislina, ki so prednostno oksidirani namesto fenolnih spojin. V poskusu je poleg tablete vitamina C prisotna tudi askorbinska kislina v naravnih virih, kot so citrusi, limona in pomaranča.
Več o oksidacija.
3. izkušnja - kdo hitreje zmrzne?
Vključeni koncepti: koligativne lastnosti in krioskopija
Materiali
- dve cevi (uporablja se za zabave)
- steklena posoda
- namizna sol
- filtrirana voda
- led
- termometer
Kako narediti
- V obe epruveti dodajte enako količino filtrirane vode. Na primer 5 ml v vsako epruveto.
- Dodajte kuhinjsko sol v eno epruveto in položite identifikacijski trak, da razločite, katera je slana.
- Stekleno posodo napolnite z zdrobljenim ledom in dodajte nekaj soli.
- Obe cevi namestite istočasno v led in opazujte, kaj se bo zgodilo.
- Zabeležite temperaturo ledišča za vsako situacijo.
Rezultat
Dodajanje topljene snovi v vodo znižuje temperaturo zmrzovanja. Zato navadna voda ponavadi zamrzne veliko hitreje kot raztopina soli in vode, če je izpostavljena enakim pogojem.
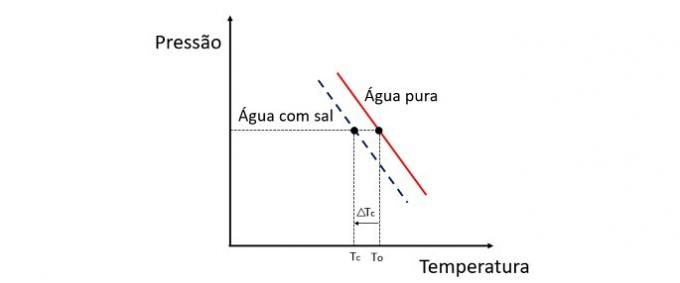
Pojasnilo
Krioskopija je koligativna lastnost, ki preučuje spremembe temperature topila, ko se v njem raztopijo različne količine topljene snovi.
Znižanje temperature zmrzovanja vode povzroča nehlapna raztopljena snov in ta pojav ima veliko praktičnih aplikacij. Zato večja koncentracija topljene snovi v raztopini vpliva na krioskopski učinek.
Če denimo voda zmrzne pri 0 ° C in ji dodamo sol, bo temperatura fazne spremembe negativna, torej veliko nižja.
Zato morska voda ne zmrzne na mestih, katerih temperatura je pod 0 ° C. Sol, raztopljena v vodi, navadno še zniža temperaturo zmrzovanja. V krajih, kjer je sneg, je običajno tudi metanje soli na ceste za taljenje ledu in izogibanje nesrečam.
Več o koligativne lastnosti.
4. poskus - razgradnja vodikovega peroksida
pojmi: kemijska reakcija in katalizator
Materiali
- Polovica surovega krompirja in pol kuhana
- Košček surovih jeter in še en kuhan kos
- Vodikov peroksid
- 2 jedi
Kako narediti
- V vsako jed dodajte hrano, krompir skupaj in jetra skupaj.
- V vsakega od štirih materialov dodajte 3 kapljice vodikovega peroksida.
- Oglejte si, kaj se zgodi, in primerjajte rezultate.
Rezultat
Vodikov peroksid, raztopina vodikovega peroksida, pride v stik s surovo hrano skoraj v trenutku.
Ta poskus lahko izvedemo tudi tako, da dodamo kos hrane v posodo z vodikovim peroksidom, da postane reakcija bolj opazna.
Pojasnilo
Šumečnost vodikovega peroksida pri stiku s surovo hrano je značilna za pojav kemične reakcije, ki je razgradnja vodikovega peroksida in sproščanje plina kisik.
Razgradnja vodikovega peroksida poteka z delovanjem encima katalaze, ki ga najdemo v organeli peroksisomov, prisotnih v živalskih in rastlinskih celicah.
Pomembno je poudariti, da se razgradnja vodikovega peroksida zgodi spontano, ob prisotnosti sončne svetlobe, vendar v zelo počasni reakciji. Vendar katalaza deluje kot katalizator in povečuje hitrost kemične reakcije.
Vodikov peroksid je lahko strupena snov za celice. Zato katalaza razgradi spojino in tvori vodo in kisik, dve snovi, ki telesu ne škodujeta.
Ko je hrana kuhana, se njene sestavine spremenijo. Spremembe, ki jih povzroči kuhanje, ogrožajo tudi delovanje katalaze z denaturacijo beljakovin.
Enako, kar opazimo s hrano, se zgodi, ko na rano položimo vodikov peroksid. Katalaza deluje in nastanejo mehurčki, ki vključujejo sproščanje kisika.
Več o kemijske reakcije.
Bibliografske reference
SVETCI, W. L. P.; MOL, G. S. (Coord.). Citizen Kemija. 1. izd. São Paulo: Nova generacija, 2011. v. 1, 2, 3.
BRAZILSKA KEMIJSKA DRUŽBA (org.) 2010. Kemija v vaši bližini: poceni poskusi za učilnico K-12. 1. izd. Sao Paulo.