Po modelu orbital, ki ga je leta 1960 ustvaril Linus Pauling, je kovalentna vez, ki tvori molekul pride do fuzije ali medsebojnega prodiranja nepopolnih orbital elementov, ki sodelujejo v Povezava. Tako se sklene, da če ima element nepopolno orbitalo (z le enim elektronom), lahko tvori le kovalentno vez. Če ima dve nepopolni orbitali, lahko vzpostavi največ dve povezavi itd.
Poglejte pa atomske orbitale atoma elementa ogljik, ki ima atomsko število enako 6 (Z = 6):
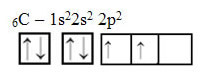
Upoštevajte, da ima dve nepopolni orbitali, zato bi moral izvesti največ dve vezavi. Vendar se to ne zgodi z njim. Kot mnogi vedo, ogljik tvori štiri vezi (je četverovalenten), zato ta model orbital ne razloži primera ogljika.
Za konec te slepe ulice je bila ustvarjena nova teorija, ki je bolje razložila to težavo: Teorija hibridizacije.

To pomeni, da je hibridizacija "mešanica" čistih orbital.
Za ogljik obstajajo tri vrste hibridizacije, in sicer: sp3, sp2 in sp.
Da bi razumeli, kako pride do hibridizacije, si oglejmo prvo vrsto hibridizacije ogljika, tip sp.3:
Ta vrsta hibridizacije se pojavi v molekuli metana (CH4). Upoštevajte, da obstajajo štiri enake kovalentne vezi med ogljikom, ki je osrednji element, in štirimi vodiki. Torej, poglejte, kaj je nepopolna vodikova orbitala:
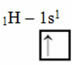
Ker ima vsak vodik nepopolno orbitalo tipa s, je treba sprejeti še en elektron, to pomeni, da vsak ustvari le eno kovalentno vez z ogljikom. Zato mora ogljik imeti štiri nepopolne orbitale. Kako se to zgodi? S hibridizacijo.
Ko elektron iz orbite 2s absorbira energijo, preide v prazno orbitalo 2p. Tako pravimo, da je ta skok elektrona z 2-ih na podnivo 2p "promocija" elektrona. Na ta način ogljik ostane v vzbujenem ali aktiviranem stanju s štirimi hibridiziranimi orbitalami za izvajanje kovalentnih vezi:
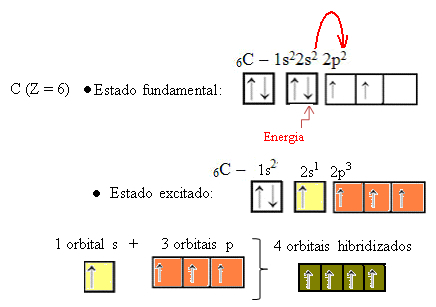
Upoštevajte, da so nastale hibridne orbitale enakovredne, vendar se razlikujejo od prvotno čistih orbitalov.
Na ta način pride do vezi med s-orbitalo vsakega od štirih atomov vodika s temi štirimi hibridiziranimi orbitalami ogljika:
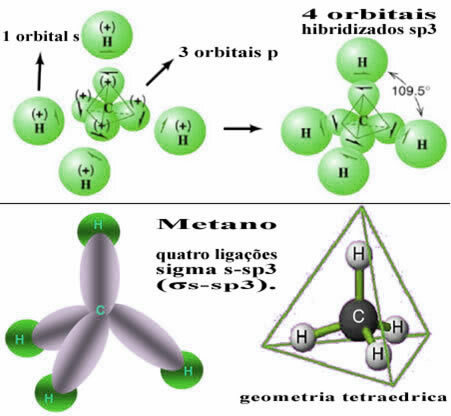
Kot je razvidno zgoraj, ima molekula metana pravilno tetraedrsko strukturo, s štirimi elektronskimi oblaki na vsaki točki in sosednjimi koti 109 ° 28 ’. Ker je bila veza vzpostavljena med s orbitalo vsakega vodika in hibridizirano sp orbitalo3 za vsako povezavo, potem imamo, da so štiri sigma s-sp povezave3 (σs-sp3).
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp3.htm


