Redoks reakcije vključujejo prenos elektronov med atomi, ioni ali molekulami.
V reakciji redukcije oksidacije pride do sprememb oksidacijskega števila (nox). Oksi-redukcija obsega oksidacijske in redukcijske procese:
- Oksidacija: Rezultati v izguba elektrona in povečan nox.
- Zmanjšanje: Rezultati v dobiček elektrona in zmanjšal nox.
Ko se en element odpove elektronom, jih bo sprejel drugi. Tako je skupno število prejetih elektronov enako skupnemu številu izgubljenih elektronov.
Primeri redoks reakcij na zgorevanje, korozijo in fotosintezo.
Primeri
Glede na element, ki sprejema ali oddaja elektrone, imamo naslednja imena:
- Reducirni agent: Tisti, ki je izpostavljen oksidaciji, povzroči redukcijo in poveča svoje nox število To je tisto, kar izgubi elektrone.
- Oksidativno sredstvo: Tisti, ki se podvrže redukciji, povzroči oksidacijo in zmanjša njegovo nox število. To je tisto, kar pridobi elektrone.
O oksidacijsko število predstavlja električni naboj elementa v času, ko sodeluje v a kemična vez.
Ta pogoj je povezan z elektronegativnost, kar je težnja nekaterih elementov, da sprejemajo elektrone.
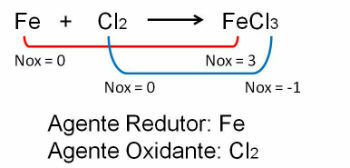
1. Upoštevajte prvi primer, upoštevajte, da se v reakciji med železom in klorom spremeni oksidacijsko število. O klor ker je bolj elektronegativen, pridobi elektrone:
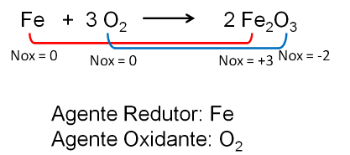
2. Reakcija med železom in kisikom. Kisik je bolj elektronegativen in na koncu prejme elektrone in zmanjša njihovo oksidacijsko število.
Izvedite več, preberite tudi:
- Oksidacija
- Izgorevanje
- Kemijske reakcije
- elektroni
Vaja rešena
1. (PUC-RS) V zvezi z oksidacijsko enačbo - neuravnoteženo zmanjšanje Fe0 + CuSO4 → Fe2(SAMO4)3 + Cu0, lahko rečemo, da:
a) oksidacijsko število bakra v bakrovem sulfatu je +1.
b) atom železa izgubi 2 elektrona.
c) baker je podvržen oksidaciji.
d) železo je oksidacijsko sredstvo.
e) železo je pod oksidacijo.
Resolucija:
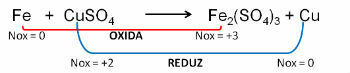
Odgovor:
e) železo je pod oksidacijo.
Vaje
1. (UFAC-AC) V naslednji kemijski enačbi: Zn + 2 HCℓ → ZnCℓ2 + H2
a) element Zn oksidira in reagira kot oksidacijsko sredstvo.
b) element Zn oksidira in reagira kot redukcijsko sredstvo.
c) element Zn se reducira in reagira kot reducent.
d) HCℓ je redukcijsko sredstvo.
e) enačba je razvrščena kot reverzibilna.
b) element Zn oksidira in reagira kot redukcijsko sredstvo.
2. (ITA-SP) V ionski reakciji Ni (s) + Cu2+(aq) → Ni2+(aq) + Cu (s)
a) nikelj je oksidant, ker je oksidiran.
b) nikelj je reduktor, ker je oksidiran.
c) bakrovi ion je oksidant, ker je oksidiran.
d) bakrovi ion je reduktor, ker je zmanjšan.
e) ni redoks reakcija, zato ni oksidanta ali reduktorja.
b) nikelj je reduktor, ker je oksidiran.
3. (UFRGS) Aktivno sredstvo v gospodinjskem belilu je hipoklorit-ion, ClO-. V postopkih beljenja se ta ion zmanjša; To pomeni da:
a) snov, na katero deluje hipoklorit, sprejme elektrone.
b) zmanjša se število elektronov v njegovi strukturi.
c) ClO- je redukcijsko sredstvo.
d) ClO- se pretvori v elementarni klor ali kloridni ion.
e) ne pride do prenosa elektronov.
d) ClO- se pretvori v elementarni klor ali kloridni ion.


