Tretji zakon termodinamike obravnava obnašanje snovi z entropijo, ki se približuje ničli.
Po tem zakonu se sistem, kadar je sistem v termodinamičnem ravnovesju, približa ničli.
Drugi zakon termodinamike se nanaša na entropijo. Nato se tretji zakon pojavi kot a poskus vzpostavitve absolutne referenčne točke, ki določa entropijo.
Walther Nernst (1864-1941) je bil fizik, ki se je ukvarjal z načeli, ki so bila podlaga za tretji zakon termodinamike.
Po Nernstu naj bi imela entropija minimalno vrednost, če bi bila temperatura čiste snovi enaka ali se približala absolutni ničli.
Za to je Nernst predlagal spodnjo formulo, ki kaže, da se spreminjanje entropije (ΔS) in temperature (T) nagiba k minimalnim vrednostim, to je 0:
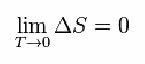
Kaj pa je Entropija?
Entropija to je način, kako se molekule organizirajo v sistemu. Ta organizacija se pretvori v motnjo, ne v smislu zmede, ampak v smislu gibanja in vznemirjenja molekul.
Več molekul se lahko premika, bolj neorganizirane so, več entropije imajo.
Sprva je Nernst predlagal, da je entropija, ki jo je predlagal, mogoča le na popolnih kristalih.
Na koncu je zaključil, da temperatura, enaka absolutni ničli, ne obstaja, zaradi česar je tretji zakon sporen zakon.
Torej, za mnoge fizike to ni zakon, ampak pravilo.
Po toliko letih (od leta 1912) znanstveniki poskušajo doseči to temperaturo ali temperature, ki se vedno bolj približujejo absolutni ničli. Tako so odkrili, da je to mogoče le v plinih, pri čemer zavržejo katero koli snov v trdnem ali tekočem stanju.
Preberite tudi:
- Ničelni zakon termodinamike
- Prvi zakon termodinamike
- Drugi zakon termodinamike
- Vaje iz termodinamike