Grafen je nanomaterial, sestavljen samo iz ogljika, v katerem se atomi povezujejo in tvorijo šesterokotne strukture.
Je najboljši znan kristal, zaradi svojih lastnosti pa je zelo zaželen. Ta material je lahek, električno prevoden, tog in nepremočljiv.
Uporabnost grafena je na več področjih. Najbolj znane so: gradbeništvo, energetika, telekomunikacije, medicina in elektronika.
Odkar so ga odkrili, ostaja grafen v središču raziskovalnega zanimanja. Študija vlog za to gradivo mobilizira institucije in naložbe v višini milijonov evrov. Tako znanstveniki po vsem svetu nenehno poskušajo razviti cenejši način za njegovo široko proizvodnjo.
Razumevanje, kaj je grafen
Grafen je alotropna oblika ogljika, kjer razporeditev atomov tega elementa tvori tanko plast.
Ta alotrop je dvodimenzionalen, torej ima le dve meritvi: širino in višino.
Da bi dobili predstavo o velikosti tega materiala, debelina lista papirja ustreza superpoziciji 3 milijonov slojev grafena.
Čeprav gre za najtanjši material, ki ga je človek izoliral in identificiral, je njegova dimenzija v nanometrskem vrstnem redu. Je lahek in močan, sposoben je bolje prevajati elektriko kot kovine, kot sta baker in silicij.
Zaradi ureditve, ki jo imajo atomi ogljika v strukturi grafena, je v njem mogoče najti zelo zanimive in zaželene lastnosti.
Uporabe grafena
Številna podjetja in raziskovalne skupine po vsem svetu objavljajo rezultate dela, ki vključuje vloge za grafen. Glej spodaj glavne.
| Pitna voda | Grafenske membrane omogočajo razsoljevanje in čiščenje morske vode. |
|---|---|
| Emisije CO2 | Grafenski filtri lahko zmanjšajo emisije CO2 z ločevanjem plinov, ki jih ustvarjajo industrije in podjetja, ki bodo zavrnjeni. |
| odkrivanje bolezni | Veliko hitrejši biomedicinski senzorji temeljijo na grafenu in lahko zaznajo bolezni, viruse in druge toksine. |
| Gradnja | Gradbeni materiali, kot sta beton in aluminij, so lažji in močnejši z dodatkom grafena. |
| Lepota | Barvanje las z brizganjem grafena, ki bi trajalo približno 30 pranj. |
| Mikronaprave | Čipi še manjši in močnejši zaradi nadomestitve silicija z grafenom. |
| Energija | Sončne celice imajo boljšo prilagodljivost, večjo preglednost in nižje proizvodne stroške z uporabo grafena. |
| Elektronika | Baterije z boljšim in hitrejšim shranjevanjem energije se lahko napolnijo v 15 minutah. |
| Mobilnost | Kolesa imajo lahko trdnejše pnevmatike in okvirje, težke 350 gramov, z uporabo grafena. |
Struktura grafena
Struktura grafena je sestavljena iz mreže ogljikov, povezanih v šesterokotnike.
Ogljikovo jedro je sestavljeno iz 6 protonov in 6 nevtronov. 6 elektronov atoma je razporejenih v dveh slojih.
Ob valentna plast obstajajo 4 elektroni, pri čemer ima ta lupina do 8. Da bi ogljik pridobil stabilnost, mora vzpostaviti 4 povezave in doseči elektronsko konfiguracijo žlahtnega plina, kot je navedeno v pravilu okteta.
Atomi v grafenski vezi z kovalentne vezi, to pomeni, da obstaja izmenjava elektronov.

Ogljik-ogljikove vezi so najmočnejše vezi, ki jih najdemo v naravi in vsak ogljik se v strukturi pridruži ostalim 3. Zato je hibridizacija atoma sp2, kar ustreza 2 enojnim in eni dvojni vezi.
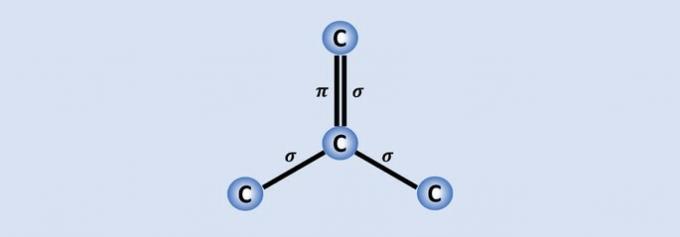
Od štirih ogljikovih elektronov se tri deli s sosednjimi atomi in eden, ki tvori vez. , pomaga grafenu, na primer, da je dober prevodnik električne energije, ker ima več "svobode" v materialu.
Grafenske lastnosti

| Svetloba | Kvadratni meter tehta le 0,77 miligrama. Grafenski aerogel je približno 12-krat lažji od zraka. |
|---|---|
| Prilagodljiv | Lahko se razširi do 25% svoje dolžine. |
| Dirigent | Njegova trenutna gostota je večja od bakra. |
| Vzdržljiv | V mrazu se razširi in v toploti skrči. Večina snovi deluje nasprotno. |
| Vodoodporen | Mreža, ki jo tvorijo ogljiki, ne dovoljuje niti prehoda atoma helija. |
| Odporen | Približno 200-krat močnejši od jekla. |
| Prosojna | Absorbira le 2,3% svetlobe. |
| Tanek | Milijonkrat tanjši od človeških las. Njegova debelina je le en atom. |
| Težko | Znan najtrši material, še bolj kot diamant. |
Zgodovina in odkritje grafena
Izraz grafen je bil prvič uporabljen leta 1987, vendar ga je União de Química Pure and Applied uradno priznal šele leta 1994.
Ta oznaka je nastala na križišču Ljubljane grafit s pripono -ene, ki se nanaša na dvojno vez snovi.
Od petdesetih let prejšnjega stoletja je Linus Pauling v svojih predavanjih govoril o obstoju tanke plasti ogljika, sestavljene iz šesterokotnih obročev. Philip Russell Wallace je pred leti opisal tudi nekatere pomembne lastnosti te zgradbe.
Vendar pa sta fizika Andre Geim in Konstantin Novoselov na univerzi v Manchestru šele pred kratkim, leta 2004, grafen izolirala in ga lahko globoko poznamo.
Preučevali so grafit in s tehniko mehanskega pilinga so z lepilnim trakom uspeli izolirati plast materiala. Ta dosežek je paru leta 2010 podelil Nobelovo nagrado.
Pomen grafena za Brazilijo
Brazilija ima ene največjih rezerv naravnega grafita, materiala, ki vsebuje grafen. Naravni rezervati grafita dosegajo 45% celotnega sveta.
Čeprav pojav grafita opažamo na celotnem brazilskem ozemlju, izkoriščene rezerve najdemo v Minas Geraisu, Cearáju in Bahii.
Z bogatimi surovinami Brazilija vlaga tudi v raziskave na tem območju. Prvi laboratorij v Latinski Ameriki, namenjen raziskovanju grafena, se nahaja v Braziliji na Universidade Presbiteriana Mackenzie v Sao Paulu, imenovan MackGraphe.
Proizvodnja grafena
Grafen lahko pripravimo iz karbida, ogljikovodika, ogljikove nanocevke in grafita. Slednji se najpogosteje uporablja kot vhodni material.
Glavne metode proizvodnje grafena so:
- Mehanski mikro piling: Grafitni kristal ima s trakom odstranjene plasti grafena, ki se nanesejo na podlago, ki vsebuje silicijev oksid.
- Kemični mikro piling: ogljikove vezi oslabijo z dodatkom reagentov in delno prekinejo mrežo.
- odlaganje kemičnih hlapov: tvorba slojev grafena, naloženih na trdne nosilce, kot je kovinska površina niklja
Cena grafena
Težavnost sinteze grafena v industrijskem merilu pomeni, da je vrednost tega materiala še vedno zelo visoka.
V primerjavi z grafitom je njegova cena tisočkrat višja. Medtem ko se 1 kg grafita prodaja za 1 dolar, se prodaja 150 g grafena za 15 000 dolarjev.
Zanimivosti o grafenu
- Projekt Evropske unije, imenovan Graphene Flagship, je približno 1,3 milijarde evrov namenil za raziskave, povezane z grafenom, aplikacijami in razvojem proizvodnje v industrijskem merilu. Pri tem projektu sodeluje približno 150 institucij v 23 državah.
- Prvi kovček, razvit za vesoljska potovanja, ima v svoji sestavi grafen. Izstrelitev je predvidena za leto 2033, ko NASA načrtuje izvedbo odprav na Mars.
- Borofen je novi tekmec grafena. Ta material je bil odkrit leta 2015 in velja za izboljšano različico grafena, saj je še bolj prilagodljiv, odporen in prevoden.
Grafen v Enem
V testu Enem 2018 je eno od vprašanj Naravoslovje in njegove tehnologije je bil o grafenu. Označite spodaj komentirano rešitev te težave.
Grafen je alotropna oblika ogljika, ki jo sestavlja ravninska plast (dvodimenzionalni niz) stisnjenih ogljikovih atomov, debelih le en atom. Njegova struktura je šesterokotna, kot je prikazano na sliki.
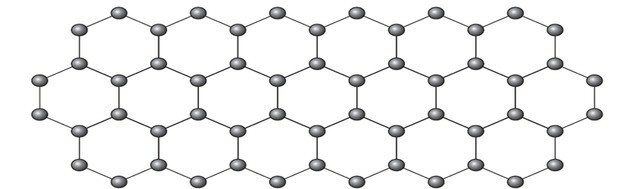
V tej ureditvi imajo atomi ogljika hibridizacijo
a) sp linearne geometrije.
b) sp2 ravninske trigonalne geometrije.
c) sp3 izmenično s sp-hibridiziranimi ogljiki linearne geometrije.
d) sp3d ravninske geometrije.
e) sp3d2 s šestkotno ravninsko geometrijo.
pravilna alternativa: b) sp2 ravninske trigonalne geometrije.
Alotropija ogljika nastane zaradi njegove sposobnosti tvorjenja različnih preprostih snovi.
Ker ima v valentni lupini 4 elektrone, je ogljik četverovalenten, to pomeni, da naredi 4 kovalentne vezi. Te obveznice so lahko enojne, dvojne ali trojne.
Odvisno od vezi, ki jo tvori ogljik, se prostorska struktura molekule spremeni v razporeditev, ki najbolje ustreza atomom.
Do hibridizacije pride, kadar obstaja kombinacija orbitalov, za ogljik pa je lahko: sp, sp2 in sp3, odvisno od vrste klicev.
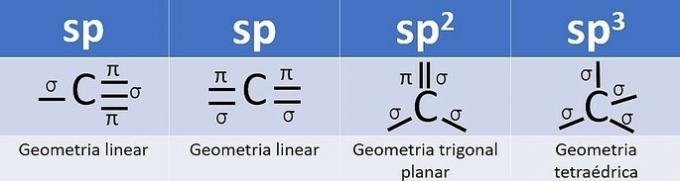
Število hibridnih orbital je vsota sigma (σ) vezi, ki jo tvori ogljik, saj vez ne hibridizira.
- sp: 2 sigma povezavi
- sp2: 3 sigma povezave
- sp3: 4 sigma povezave
Zastopanost grafenskega alotropa v kroglicah in palicah, kot je prikazano na sliki v vprašanju, ne kaže na prave vezi snovi.
Če pa pogledamo del slike, vidimo, da obstaja en ogljik, ki predstavlja kroglo, ki se povezuje s tremi drugimi ogljiki, ki tvorijo strukturo kot trikotnik.
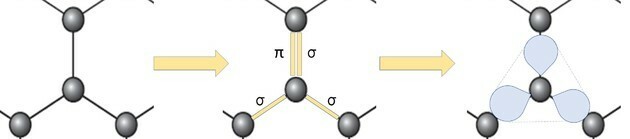
Če ogljik potrebuje 4 vezi in je vezan na 3 druge ogljike, potem je ena od teh vezi dvojna.
Ker ima eno dvojno in dve enojni vezi, ima grafen sp hibridizacijo2 in posledično trigonalna ravninska geometrija.
Druge znane alotropne oblike ogljika so: grafit, diamant, fuleren in nanocevka. Čeprav so vsi izdelani iz ogljika, imajo alotropi različne lastnosti, ki izhajajo iz njihove različne strukture.
Preberite tudi vi: Kemija v Enem in Vprašanja o kemiji v Enem.


